7.用中和滴定法测量某烧碱的纯度,试根据实验步骤填写下列空白:
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
根据上表中的数据,可求得NaOH固体的纯度为95%.
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
(1)配制待测溶液,将4.21g含有少量不与盐酸反应的杂质的NaOH固体配成250.00mL待测液,需用到的仪器有烧杯、玻璃棒、胶头滴管、250mL 容量瓶.
(2)把0.4mol•L-1的标准盐酸溶液注入洁净的酸式滴定管中,使液面刻度在“0”以上,固定后,轻轻旋转活塞使滴定管尖嘴部分充满溶液,然后调整液面保持在0刻度或0刻度以下,记下读数;用碱式滴定管向锥形瓶中加入20.00mL待测溶液,并加几滴甲基橙作指示剂.
(3)实验数据
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
(4)误差分析,若滴定前仰视酸式滴定管读数,终点读法正确,其测得结果偏低(偏高、偏低)
6. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
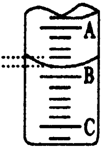
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
3.某同学在学习硝酸与硫酸时,对两种酸与铜的反应情况进行研究,试完成下列各题.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
(2)充分反应后,将甲、乙烧杯混合,再使之充分反应,最终所得溶液溶质为CuSO4、Cu(NO3)2,剩余固体总质量为2.24 g
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
| 实验示意图 | 实验现象 | 解释 |
甲: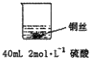 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
1. 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
11.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
0 168304 168312 168318 168322 168328 168330 168334 168340 168342 168348 168354 168358 168360 168364 168370 168372 168378 168382 168384 168388 168390 168394 168396 168398 168399 168400 168402 168403 168404 168406 168408 168412 168414 168418 168420 168424 168430 168432 168438 168442 168444 168448 168454 168460 168462 168468 168472 168474 168480 168484 168490 168498 203614
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
 溶液中的离子反应
溶液中的离子反应


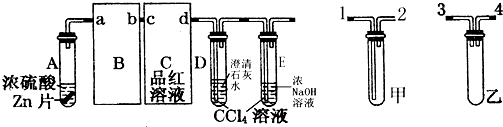
 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.