题目内容
6. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
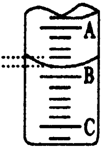
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
分析 (1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂; 量取酸应该用酸式滴定管;
(2)当达到终点时,醋酸完全反应,溶液显弱碱性,溶液颜色由无色变为浅红色(或红色);
(3)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度 25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(4)根据c(酸)=$\frac{c(碱)•V(碱)}{V(酸)}$,判断不当操作对相关物理量的影响;
(5)利用平均值计算醋酸溶液的体积,再根据酸度公式计算其物质的量浓度.
解答 解:(1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;白醋是酸,应该用酸式滴定管量取;
故答案为:酚酞;酸式滴定管;
(2)当达到终点时,醋酸完全反应,溶液显弱碱性,溶液颜色由无色变为浅红色(或红色),则滴定至终点的判断方法为:当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色;
故答案为:当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色;
(3)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,由于滴定管50.00mL刻度下方还有液体,所以实际溶液的液体大于24.60mL,
故答案为:25.40;大于24.60mL;
(4)从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,测得的醋酸浓度偏大,
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,导致氢氧化钠体积偏小,所以所测醋酸浓度偏小,故错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,导致氢氧化钠体积偏大,所以所测醋酸浓度偏大,故正确;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致氢氧化钠浓度偏小,所以所用氢氧化钠体积偏大,所测醋酸浓度偏大,故正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,润洗锥形瓶导致醋酸的物质的量偏大,所以使用的氢氧化钠体积偏大,所测醋酸浓度判断,故正确;
E.该NaOH标准液保存时间过长,有部分变质,浓度降低,如用酚酞为指示剂,最终产物不变,没有影响,故错误;
F.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,导致使用的氢氧化钠体积偏小,所测醋酸浓度偏小,故错误;
故答案为:BCD;
(5)根据c(酸)=$\frac{c(碱)•V(碱)}{V(酸)}$,醋酸的物质的量浓度c=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$;
故答案为:$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
点评 本题考查酸碱滴定实验,难度中等,会根据实际需要选取指示剂,注意滴定管上的刻度和量筒上刻度的区别,为易错点.

| A. | Ba(OH)2•8H2O+2NH4Cl=BaCl2•6H2O+2NH3•2H2O+2H2O | |
| B. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | |
| D. | 8Al+3Fe3O4=4Al2O3+9Fe |
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③将苯和溴水混合后加入铁粉制取溴苯
④苯和硝基苯混合物采用分液的方法分离.
| A. | 只有①② | B. | 只有③④ | C. | 只有①③ | D. | ①②③④ |

 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题: