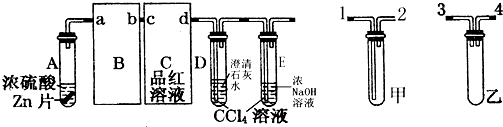
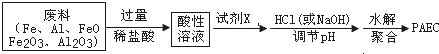
题目内容
9.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:A.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
B.在250mL容量瓶中定容成250mL烧碱溶液
C.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞
D.将物质的量浓度为M mol/L的标准盐酸装入酸式滴定管,调整液面,记下开始刻度为V1mL.
E.锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL
回答下列问题:
(1)滴定达到终点的现象是当滴进最后一滴溶液由红色变无色,且半分钟内不变色;
(2)若酸式滴定管没有用标准盐酸润洗,会对测定结果有何影响偏高(填“偏高”“偏低”或“无影响”,其它操作均正确)
(3)该烧碱样品的纯度计算式是$\frac{40M({V}_{2}-{V}_{1})}{W}$%.
分析 (1)根据用酚酞作指示剂时,当滴进最后一滴溶液由红色变无色,且半分钟内不变色,则到达滴定终点;
(2)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对c(待测)的影响,以此判断浓度的误差;
(3)根据消耗盐酸的平均体积和物质的量浓度求出氢氧化钠的物质的量,再计算烧碱样品的纯度.
解答 解:(1)用酚酞作指示剂时,当滴进最后一滴溶液由红色变无色,且半分钟内不变色,则到达滴定终点;
故答案为:当滴进最后一滴溶液由红色变无色,且半分钟内不变色;
(2)若酸式滴定管没用标准盐酸润洗,标准液浓度降低,造成V(标)偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析可知c(待测)偏高;
故答案为:偏高;
(3)所耗盐酸标准液的体积分别为:(V2-V1)mL,依据
HCl~~~~~~NaOH
M mol/L×(V2-V1)×10-3L n(NaOH)
n(NaOH)=M(V2-V1)×10-3mol,
250mL的溶液中含有NaOH的质量为:M(V2-V1)×10-3mol×$\frac{250mL}{25mL}$×40g/mol,
烧碱样品的纯度为$\frac{M({V}_{2}-{V}_{1})×1{0}^{-3}mol×\frac{250mL}{25mL}×40g/mol}{Wg}$×100%=$\frac{40M({V}_{2}-{V}_{1})}{W}$%,
故答案为:$\frac{40M({V}_{2}-{V}_{1})}{W}$%.
点评 本题主要考查了酸碱中和滴定的操作、误差分析以及有关的化学计算,难度中等,掌握中和滴定的原理是解题的关键.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
11.有如下有机物,请将它所对应的类别用序号填入下列表格中:
(1)CH3CH2CH3 ①烯烃
(2)CH2=CH-CH3 ②烷烃
(3)CH3-OH ③醛
(4)CH3-CHO ④醇
(1)CH3CH2CH3 ①烯烃
(2)CH2=CH-CH3 ②烷烃
(3)CH3-OH ③醛
(4)CH3-CHO ④醇
| 物质编号 | 所属类别编号 | 物质编号 | 所属类别编号 |
| (1) | (3) | ||
| (2) | (4) |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法正确的是( )
| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z的最高价氧化物对应的水化物是酸 |
19.下列叙述中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在周期数 | |
| B. | 稀有气体元素原子的最外层电子数都是8 | |
| C. | 元素周期表从ⅢB到ⅡB 10个纵行的元素都是金属元素 | |
| D. | 短周期元素中,若两种元素的原子序数相差8,则它们的周期数一定相差1 |