题目内容
4.某校化学研究性学习小组对浓硫酸与金属锌的反应进行探究.首先按图组装好实验装置,然后取一定量的浓硫酸与足量Zn充分反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑浊消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加.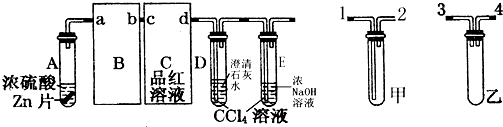
试回答:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接3(或4)、4(或3)接b,c接1、2接d;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,该实验中起到同样作用的装置是乙;
(3)能证明浓硫酸具有强氧化性的实验现象为C中品红溶液褪色;
(4)反应较长时间后气泡量又会明显增加的原因是浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2.
分析 (1)B的作用是防止倒吸,应该选用装置乙;C装置的作用是检验二氧化硫的漂白性,可用洗气装置;
(2)装置乙也具有防止倒吸的作用;
(2)浓硫酸与锌反应生成硫酸锌、二氧化硫气体和水,有二氧化硫生成能证明浓硫酸具有强氧化性;
(3)随反应进行浓H2SO4变成稀H2SO4,锌与稀硫酸反应生成氢气.
解答 解:(1)B的作用是防止倒吸,装置乙为安全瓶,具有防止倒吸的作用;C装置的作用是检验二氧化硫的漂白性,可用洗气装置,可将甲填入C中,且为长进短出,所以正确的连接顺序为:a接3(或4),4(或3)接b,c接1,2接d,
故答案为:3或4;4或3; 1; 2;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,装置乙为安全瓶,也能够防止倒吸,
故答案为:乙;
(3)浓硫酸与锌反应的化学方程式为:Zn+2H2SO4=ZnSO4+SO2↑+2H2O,有二氧化硫生成能证明浓硫酸具有强氧化性,C中品红溶液同时,证明生成了二氧化硫,从而证明浓硫酸具有强氧化性,
故答案为:C中品红溶液褪色;
(4)随反应的进行浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2,所以生成气泡量又会明显增加,
故答案为:浓H2SO4变成稀H2SO4,稀硫酸与Zn反应放出H2.
点评 本题考查了浓硫酸的性质、二氧化硫的检验方法,题目难度中等,注意掌握锌与浓硫酸的反应原理,本题中注意锌能够浓硫酸、稀硫酸反应,明确实验目的及基本操作方法为解答关键.

练习册系列答案
相关题目
5.下列物质中,只含有非极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | P4 | D. | H2O2 |
3.下列各组微粒中,都互为等子体的是( )
| A. | CO、NO、NaH、N2 | |
| B. | SO2、N+2+2、N−3−3、CNO- | |
| C. | CO2−32−3、NO−3−3、BeCl2 | |
| D. | SiF4、SiO4−44−4、SO2−42−4、PO3−43−4 |
13.高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途.湿法、干法制备高铁酸钾的原理如表所示:
(1)某工厂用湿法制备高铁酸钾的流程如图所示:

①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应Ⅱ的离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol•L-1.则需调整pH=3时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾.
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2强(填“强”或“弱”).
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3:1.
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |

①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应Ⅱ的离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol•L-1.则需调整pH=3时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾.
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2强(填“强”或“弱”).
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3:1.

 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验: