题目内容
11.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究,实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是控制分液漏斗的活塞,使浓硫酸缓慢滴入A中.
(4)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是A中反应一会生成二氧化硫,C中才能反应.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
分析 (1)仪器a的名称是分液漏斗;
(2)浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠;
(3)①装置B中所盛放的液体应不能够与二氧化硫反应;
②如使SO2缓慢进入烧瓶C,应使A中缓慢反应;
(4)①据得失电子守恒和原子守恒配平化学方程式;
②先使C中充满二氧化硫,C中才能反应;
③根据将Na2S2O3结晶析出的操作分析;
(5)①取Wg产品配成稀溶液;
②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂志可能有Na2CO3、Na2SO3、Na2SO4,
③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有Na2SO4,一定有Na2SO3,可能有Na2CO3,
④据反应方程式和碘的量计算硫代硫酸钠的质量,进而计算纯度.
解答 解:(1)仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)①装置B中所盛放的液体应不能够与二氧化硫反应,二氧化硫能够溶于水,能够与亚硫酸钠和碳酸氢钠溶液反应,故答案为:C;
②如使SO2缓慢进入烧瓶C,应使A中缓慢反应,控制分液漏斗的活塞,使浓硫酸缓慢滴入A中,故答案为:控制分液漏斗的活塞,使浓硫酸缓慢滴入A中;
(4)①S元素在二氧化硫中为+4价,在硫化钠中为-2价,反应后为+2价,所以二氧化硫和硫化钠物质的量之比为2:1,据原子守恒,二氧化硫钱的化学计量数为4,硫化钠的化学计量数为2,据原子守恒,还生成二氧化碳,化学方程式为4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,故答案为:4;2;1;3;CO2;
②先使C中充满二氧化硫,C中才能反应,故答案为:A中反应一会生成二氧化硫,C中才能反应;
③将Na2S2O3结晶析出的操作应为:蒸发、结晶、过滤、洗涤、干燥,故答案为:蒸发;
(5)向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂志可能有Na2CO3、Na2SO3、Na2SO4,向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有Na2SO4,一定有Na2SO3,可能有Na2CO3,据反应方程式,消耗0.100 0mol•L-1×0.01810L=0.001810mol碘,能够反应0.00362mol硫代硫酸钠,质量为0.00362mol×248g/mol=8.9776g,所以产品纯度为$\frac{8.9776g}{wg}$×100%≈$\frac{9}{w}$×100%,故答案为:Na2SO3;Na2SO3;Na2S;Na2CO3;Na2SO4;$\frac{9}{w}$×100%.
点评 本题以制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了氧化还原反应方程式书写、配平以及物质的分离提纯、检验、设计优化等,综合性较强.

| A. | 钠是密度小、硬度大、熔点高的银白色金属 | |
| B. | 钠在纯净的氧气中充分燃烧,生成白色固体Na2O | |
| C. | 将金属钠放入CuSO4溶液中,可观察到大量红色的铜析出 | |
| D. | 将金属钠放入水中立即熔化成小球,说明金属钠熔点低,且反应放出热量 |
| A. | 氢气热值高,其燃烧产物是水,是一种理想的清洁燃料 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 石油作为重要的可再生能源应该被尽量地利用 |
| A. | 0.2mol/(L•S) | B. | 0.1mol/(L•S) | C. | 0.04mol/(L•S) | D. | 0.08mol/(L•S) |
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
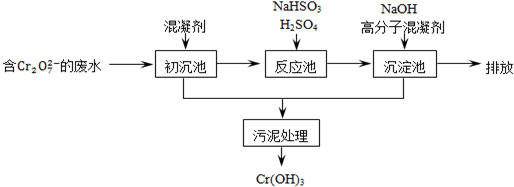
(1)Cr在周期表中的位置为第四周期第ⅥB族.
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
Al3++3H2O?Al(OH)3+3H+.
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
1Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O.
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和Cr3++3OH-=Cr(OH)3↓.证明Cr3+沉淀完全的方法是取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
| A. | 可溶于水 | B. | 水溶液能导电 | C. | 熔融状态可导电 | D. | 熔点350℃ |
 ;
;


 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答: