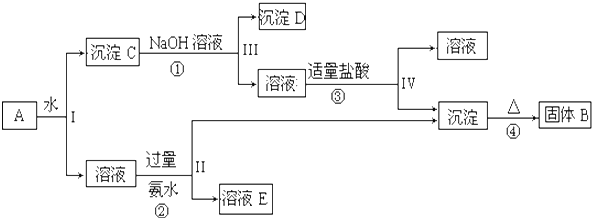
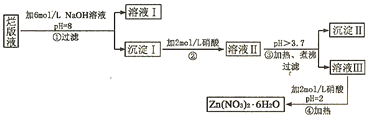
题目内容
8. 溶液中的离子反应
溶液中的离子反应(1)某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验.化学反应如下:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,实验主要步骤如下:
Ⅰ.称取2.80g草酸晶体(H2C2O4•2H2O)配成100ml草酸溶液
Ⅱ.取25.00ml草酸溶液于锥形瓶中,加入适量稀硫酸,用0.1000mol•L-1酸性高锰酸钾溶液滴定,消耗KMnO4溶液20.00ml
根据步骤Ⅱ请回答:
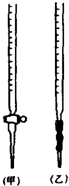
①高锰酸钾溶液应盛装于甲(如图,填“甲”或“乙”)滴定管.
②滴定到达终点的判断标志是:加入最后一滴KMnO4溶液,溶液变为浅紫色,且30s内红色不褪去
③该草酸晶体的质量分数为:90%
④下列造成草酸晶体质量分数偏高的是BC
A、滴定终点读数时俯视 B、滴定前有气泡,滴定后气泡消失C、润洗锥形瓶 D、滴定过程中加入少量蒸馏水冲洗瓶壁
(2)在25℃下,将一定浓度的氨水与0.018mol/L的硫酸等体积混合,反应后的溶液中c(NH4+)=2c(SO42-).按要求回答下列问题:反应后的溶液呈中性(填“酸”、“中”或“碱”),此时溶液中c(NH4+)=0.018mol•L-1c(NH3•H2O)=1.0×10-4mol•L-1.已知:Kb(NH3•H2O)=1.8×10-5.
分析 (1)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
②草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
③由关系式2KMnO4~5H2C2O4可知n(H2C2O4)=$\frac{5}{2}$V(KMnO4)•c(KMnO4),然后求出草酸的质量和质量分数;
④由关系式2KMnO4~5H2C2O4可知V(KMnO4)•c(KMnO4)=$\frac{2}{5}$V(H2C2O4)•c(H2C2O4),即c(H2C2O4)=$\frac{5}{2}$×$\frac{c(KMn{O}_{4})×V(KMn{O}_{4})}{V({H}_{2}{C}_{2}{O}_{4})}$,据此分析判断;
(2)由电荷守恒式c(H+)+c(NH4+)=2c(SO42-)+c(OH-)及信息中c(NH4+)=2c(SO42-)分析溶液的酸碱性,c(SO42-)=$\frac{0.018mol/L×V}{2V}$=0.009mol/L,Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$.
解答 解:(1)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,甲为酸式滴定管,故答案为:甲;
②高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为浅紫色,红色30s内不褪去,说明滴定到终点,
故答案为:加入最后一滴KMnO4溶液,溶液变为浅紫色,且30s内红色不褪去;
③由关系式 2KMnO4~5H2C2O4可知,n(H2C2O4)=$\frac{5}{2}$V(KMnO4)•c(KMnO4)=$\frac{5}{2}$×0.1000mol•L-1×0.0200L=0.005mol,则100mL草酸溶液中草酸物质的量0.005mol×$\frac{100}{25}$=0.02mol,草酸晶体的质量分数=$\frac{0.02mol×126g/mol}{2.80g}$×100%=90%,
故答案为:90%.
④由关系式2KMnO4~5H2C2O4可知V(KMnO4)•c(KMnO4)=$\frac{2}{5}$V(H2C2O4)•c(H2C2O4),即c(H2C2O4)=$\frac{5}{2}$×$\frac{c(KMn{O}_{4})×V(KMn{O}_{4})}{V({H}_{2}{C}_{2}{O}_{4})}$,
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(2)由电荷守恒式c(H+)+c(NH4+)=2c(SO42-)+c(OH-)、c(NH4+)=2c(SO42-)可知,c(H+)=c(OH-),溶液为中性,
c(SO42-)=$\frac{0.018mol/L×V}{2V}$=0.009mol/L,c(NH4+)=0.018mol/L,
Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,则c(NH3•H2O)=$\frac{0.018×1×1{0}^{-7}}{1.8×1{0}^{-5}}$=1.0×10-4mol/L,
故答案为:中;0.018;1.0×10-4.
点评 本题考查氧化还原滴定原理、酸碱混合的计算,难度中等,理解实验原理、溶液中的电离守恒、电离平衡常数的计算即可解答,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

 名校课堂系列答案
名校课堂系列答案2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O-H和O=O键的键能分别为436、462和akJ•mol-1,则a为( )
| A. | 1352 | B. | 1456 | C. | 496 | D. | 360 |
| A. | Ds原子在周期表中位于第7周期第ⅦB族 | |
| B. | Ds是过渡元素 | |
| C. | Ds原子的核外电子数为110 | |
| D. | Ds为金属元素 |
(1)在甲、乙两个烧杯中,分别装入 40mL 浓度均为 2mol•L-1的稀硫酸和稀硝酸,并向其中各加入 4g 束状铜丝,观察现象,试完成下列实验报告:
| 实验示意图 | 实验现象 | 解释 |
甲: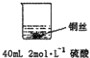 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: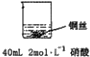 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
(3)若甲中硫酸溶液体积 V(V>40mL)可变,其余数据不变,则:
①当甲、乙烧杯混合充分反应后,溶液中只有一种溶质时,V=60mL
②能否通过硫酸溶液体积的改变,使铜丝在甲、乙烧杯混合充分反应后完全溶解?试写出推理过程否.
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.(1)滴定:①用酸式滴定管盛装1.00mol/L盐酸标准液.如图表示某次滴定时50mL滴定管中前后液面的位置.请将用去的标准盐酸的体积填入③表空格中.滴定管中剩余液体的体积大于.0.10mL(填大于、小于或者等于).
②下表是3种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 8.2-10.0 |
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20 | 0.50 | 25.12 | 24.62 |
| 2 | 20 | 如图 | 如图 | 填写24.60 |
| 3 | 20 | 6.00 | 30.58 | 24.58 |
(3)下列几种情况会使测定结果偏高的是ce
a.若滴定前用蒸馏水冲洗锥形瓶;
b.滴定后俯视读数;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定.
e.未用标准液润洗酸式滴定管.
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性HX>H2Y>ZH3 | ||
| C. | 电负性:X>Y>Z | D. | 非金属性:X>Y>Z |
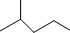 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.