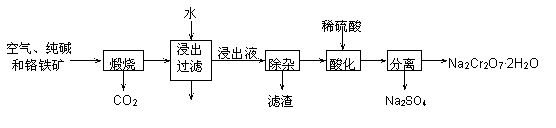
9.“Cl化学”是指以碳单质或分子中含有1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的工艺,对开发新能源和控制环境污染有重要意义.
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
请回答:①c1=c2(填“>”“<”或“=”),a=19.6
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
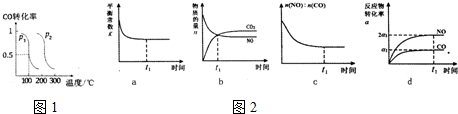
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
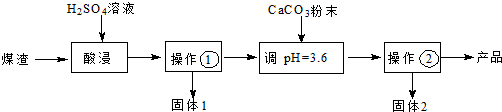
8.某研究小组从一含锌废渣(质量百分组成:40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2•ZnCO3.
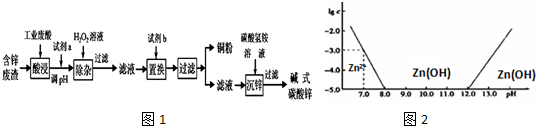
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)

部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)
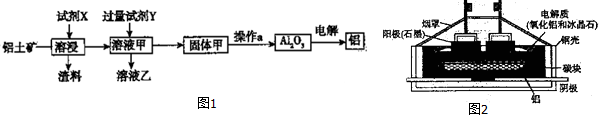
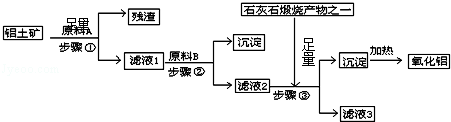
5.金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”.工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:

已知:2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.

(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度(s)与pH关系如图1,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
②TiO2+水解的离子方程式为TiO2++2H2O?TiO(OH)2+2H+.
向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解.当溶液pH接近3时,TiO(OH)2已沉淀完全.
(3)TiCl4$\stackrel{Mg}{→}$Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用右图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.写出阳极上所发生的反应式:C+2O2--4e-=CO2↑.

已知:2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.

(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度(s)与pH关系如图1,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
②TiO2+水解的离子方程式为TiO2++2H2O?TiO(OH)2+2H+.
向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解.当溶液pH接近3时,TiO(OH)2已沉淀完全.
(3)TiCl4$\stackrel{Mg}{→}$Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
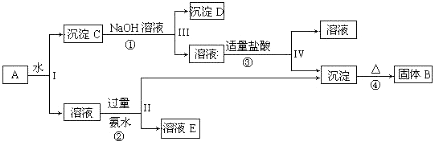
2.氨水、胆矾都是中学实验室中常见的化学试剂,它们在工农业生产上也都有广泛应用.
某研究性学习小组为测定氨水的浓度,并用氨水作提纯胆矾时的试剂,根据所查阅资料设计实验如下:
查阅资料:
①甲基橙的变色范围:pH<3.1红色,pH=3.1~4.4橙色,pH>4.4黄色
②酚酞的变色范围:pH<8.2无色,pH=8.2~10.0粉红色,pH>10.0红色
③已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时相应的pH如下表1:
表2
实验一 标定氨水的浓度
取25.00mL约为0.10mol•L-1氨水于锥形瓶中,用0.1000mol•L-1盐酸进行滴定,实验所得数据如上表2所示:
(1)滴定产物水解的离子方程式为NH4Cl+H2O?NH3.H2O+HCl,由此可推知选择的滴定指示剂应为甲基橙.(填“甲基橙”或“酚酞”)
(2)该氨水的准确浓度为0.1000mol•L-1.(精确到小数点后四位)
(3)编号3中溶液的离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
实验二 提纯胆矾晶体
某学习小组同学拟从含FeSO4、Fe2(SO4)3杂质的CuSO4溶液中提纯胆矾,其主要实验步骤如下:
第一步 往混合液中加入3% H2O2溶液充分反应后,再加入稀氨水调节溶液pH,过滤.
第二步 往滤液中加入稀硫酸调节溶液pH 至1~2,提纯胆矾.
(4)加入3% H2O2溶液的作用是将Fe 2+氧化为Fe 3+.
(5)加稀氨水调节pH应调至范围3.7-5.2之间.
(6)下列物质可用来替代稀氨水的是BC.(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3.
0 168279 168287 168293 168297 168303 168305 168309 168315 168317 168323 168329 168333 168335 168339 168345 168347 168353 168357 168359 168363 168365 168369 168371 168373 168374 168375 168377 168378 168379 168381 168383 168387 168389 168393 168395 168399 168405 168407 168413 168417 168419 168423 168429 168435 168437 168443 168447 168449 168455 168459 168465 168473 203614
某研究性学习小组为测定氨水的浓度,并用氨水作提纯胆矾时的试剂,根据所查阅资料设计实验如下:
查阅资料:
①甲基橙的变色范围:pH<3.1红色,pH=3.1~4.4橙色,pH>4.4黄色
②酚酞的变色范围:pH<8.2无色,pH=8.2~10.0粉红色,pH>10.0红色
③已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时相应的pH如下表1:
| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
| 表1 | |||
| 编号 | 1 | 2 | 3 | 4 | |
| 盐酸体积/mL | 25.05 | 25.00 | 26.80 | 24.95 | |
实验一 标定氨水的浓度
取25.00mL约为0.10mol•L-1氨水于锥形瓶中,用0.1000mol•L-1盐酸进行滴定,实验所得数据如上表2所示:
(1)滴定产物水解的离子方程式为NH4Cl+H2O?NH3.H2O+HCl,由此可推知选择的滴定指示剂应为甲基橙.(填“甲基橙”或“酚酞”)
(2)该氨水的准确浓度为0.1000mol•L-1.(精确到小数点后四位)
(3)编号3中溶液的离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
实验二 提纯胆矾晶体
某学习小组同学拟从含FeSO4、Fe2(SO4)3杂质的CuSO4溶液中提纯胆矾,其主要实验步骤如下:
第一步 往混合液中加入3% H2O2溶液充分反应后,再加入稀氨水调节溶液pH,过滤.
第二步 往滤液中加入稀硫酸调节溶液pH 至1~2,提纯胆矾.
(4)加入3% H2O2溶液的作用是将Fe 2+氧化为Fe 3+.
(5)加稀氨水调节pH应调至范围3.7-5.2之间.
(6)下列物质可用来替代稀氨水的是BC.(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3.