题目内容
3.有如图所示A~F六种仪器: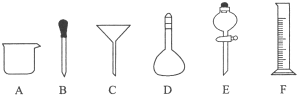
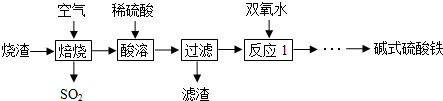
(1)写出仪器名称.C漏斗,D容量瓶;
(2)下列实验操作中用到仪器E的是a(选填下列选项的字母编号).
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
(3)某化学兴趣小组计划用氯气和氢氧化钠溶液制取消毒液.
①其反应原理为(用化学方程式表示)Cl2+2NaOH=NaCl+NaClO+H2O
②拟用0.5mol•L-1 的NaOH溶液,这种溶液0.4L才能与2.24L氯气(标准状况)恰好完全反应.
③若配制250mL0.5mol•L-1 NaOH溶液,所需称量的氢氧化钠固体的质量是5.0g.实验中需要用到的上述仪器有ABD(F)(填符号),
在配制过程中,下列情况会使所配溶液浓度偏低的是ABE.
A.用滤纸称量氢氧化钠固体
B.溶解搅拌时有部分液体溅出
C.溶解时未冷却至室温
D.加水至刻度线后摇匀,发现液面低于刻度线.
E.在定容时,仰视刻度线
F.洗涤容量瓶后,未干燥,瓶中有少量蒸馏水.
分析 (1)C是漏斗、D是容量瓶;
(2)E是分液漏斗,用于分离互不相溶的液体;
(3)①氯气和NaOH反应生成NaCl、NaClO和水;
②根据方程式Cl2+2NaOH=NaCl+NaClO+H2O知,氯气和NaOH以1:2反应;
③m(NaOH)=CVM,配制一定物质的量浓度溶液需要烧杯、胶头滴管、容量瓶;
根据C=$\frac{n}{V}$知,如果n偏小或V偏大都导致C偏低.
解答 解:(1)C是漏斗、D是容量瓶,故答案为:漏斗;容量瓶;
(2)E是分液漏斗,用于分离互不相溶的液体,
a.水和CCl4不互溶,二者混合分层,应该采用分液方法分离,使用的仪器是分液漏斗,故正确;
b.水和酒精互溶,二者应该根据熔沸点不同采用蒸馏方法分离,故错误;
c.分离水和泥砂的混合物应该采用过滤方法分离,故错误;
故选a;
(3)①氯气和NaOH反应生成NaCl、NaClO和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
②根据方程式Cl2+2NaOH=NaCl+NaClO+H2O知,氯气和NaOH以1:2反应,n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式知,0.1mol氯气完全反应需要0.2molNaOH,V(NaOH)=$\frac{0.2mol}{0.5mol/L}$=0.4L,故答案为:0.4;
③m(NaOH)=CVM=0.5mol/L×0.25L×40g/mol=5.0g,配制一定物质的量浓度溶液需要烧杯、胶头滴管、容量瓶,还可以用量筒量取水;
A.用滤纸称量氢氧化钠固体,NaOH吸水,导致n偏小,则配制溶液浓度偏低,故正确;
B.溶解搅拌时有部分液体溅出,导致n偏小,则配制溶液浓度偏低,故正确;
C.溶解时未冷却至室温,导致V偏小,配制溶液浓度偏高,故错误;
D.加水至刻度线后摇匀,发现液面低于刻度线,n、V都不变,则配制溶液浓度不变,故错误;
E.在定容时,仰视刻度线,V偏大,导致C偏低,故正确;
F.洗涤容量瓶后,未干燥,瓶中有少量蒸馏水,n、V都不变,则配制溶液浓度不变,故错误;
故答案为:5.0g;ABD(F);ABE.
点评 本题考查一定物质的量浓度溶液配制、物质分离和提纯,侧重考查基本理论,会根据物质的性质确定分离方法,易错点是配制溶液误差分析,注意容量瓶中含有少量蒸馏水不影响配制溶液浓度.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |

已知:25℃时,Ksp[Fe(OH)3]=2.79×10-39
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3.
③已知:Fe(OH)3(s)?Fe3+ (aq)+3OH-(aq)△H=akJ/mol
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(s)+3H+ (aq)△H=(3b-a)kJ/mol.水解平衡常数Kh=$\frac{1{0}^{-3}}{2.79}$.
④加盐酸调整pH为2~3的目的为抑制CoCl2水解.
⑤操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
(2)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示).电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式:CoO2+Li++e-=LiCoO2.
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
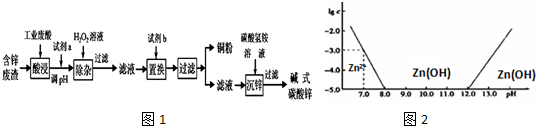
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)
| A. | CH4分子的比例模型: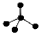 | B. | 氯原子的结构示意图: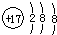 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CS2结构式:S=C=S |
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3 (稀)→Cu(NO3)2 | ||
| C. | Cu→CuO→Cu(NO3)2 | D. | Cu→CuSO4→Cu(NO3)2 |