题目内容
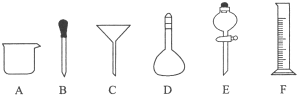
8.某研究小组从一含锌废渣(质量百分组成:40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2•ZnCO3.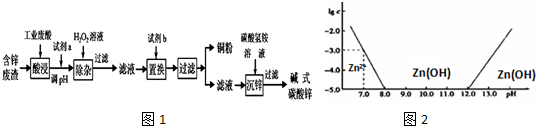
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)
分析 生产Zn(NO3)2•6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2),加入酸,溶解,加ZnO或Zn(OH)2消耗溶液中的氢离子调节PH,再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,然后过滤,后得到滤液含有Zn2+、Cu2+,再加Zn粉把铜离子置换为Cu,过滤,过滤得到硫酸锌溶液,在滤液中加碳酸氢铵,生成碱式碳酸锌,过滤得到碱式碳酸锌;
(1)根据图2可知,当pH=7时,c(Zn2+)=10-3mol/L,根据Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)计算;
(2)根据流程分析判断试剂a、b;
(3)H2O2与Fe2+反应生成水和铁离子;
(4)硫酸锌与碳酸氢铵反应生成碱式碳酸锌和二氧化碳、水;
(5)碱式碳酸锌受热分解生成ZnO、二氧化碳和水;
(6)灼烧时ZnCO3不分解,碱式碳酸锌分解,根据物质灼烧前后质量的变化确定生成的二氧化碳和水的质量,然后求出碱式碳酸锌的质量.
解答 解:生产Zn(NO3)2•6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(40.5%ZnO、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2),加入酸,溶解,加ZnO或Zn(OH)2消耗溶液中的氢离子调节PH,再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,然后过滤,后得到滤液含有Zn2+、Cu2+,再加Zn粉把铜离子置换为Cu,过滤,过滤得到硫酸锌溶液,在滤液中加碳酸氢铵,生成碱式碳酸锌,过滤得到碱式碳酸锌;
(1)根据图2可知,当pH=7时,c(Zn2+)=10-3mol/L,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=10-3×(10-7)2=1×10-17,故答案为:1×10-17;
(2)根据流程分析可知试剂a用于调节溶液的pH,但不能引入杂质,所以a为ZnO或Zn(OH)2,b试剂用于置换铜离子,则b为Zn,故答案为:ZnO或Zn(OH)2;Zn;
(3)H2O2与Fe2+反应生成水和铁离子,其饭的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)硫酸锌与碳酸氢铵反应生成碱式碳酸锌和二氧化碳、水、硫酸铵,其反应的离子方程式为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;反应后生成产物留在溶液中的主要是硫酸铵;
故答案为:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O;(NH4)2SO4;
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,另外还有二氧化碳和水,其反应方程式为Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,
故答案为:Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O;
(6)灼烧时ZnCO3不分解,碱式碳酸锌分解Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O,根据物质灼烧前后质量的变化确定生成的二氧化碳和水的质量,然后求出碱式碳酸锌的质量,所以能通过固体质量的减少量来确定固体的成分,故答案为:能.
点评 本题考查晶体的制备及混合物的分离、提纯,注意已知信息与所学知识的结合来分析解答问题,除杂流程及表格数据是解答本题的关键,题目难度中等,侧重于考查学生的实验能力和对基础知识的综合应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
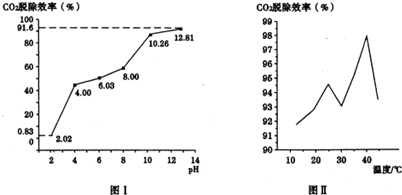
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式CO2+NH3•H2O═NH4HCO3.
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是CO2脱除效率随吸收剂的pH增大而增大.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为0.13mol(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成二氧化碳.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为44.4%(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).
①
 ②
② ③
③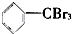 ④
④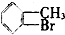 ⑤
⑤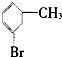 ⑥
⑥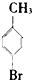 ⑦
⑦
| A. | 仅①②③ | B. | 仅⑦ | C. | 仅④⑤⑥⑦ | D. | 全部 |

 ,元素B在周期表中的位置2周期ⅥA族.
,元素B在周期表中的位置2周期ⅥA族.