题目内容
10.以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7•2H2O)的主要工艺流程如下:
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:Al2O3+Na2CO3$\frac{\underline{\;煅烧\;}}{\;}$2NaAlO2+CO2↑;
(2)酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,
CrO42-有$\frac{10}{11}$转化为Cr2O72-.
①酸化时发生反应的平衡常数K的表达式为K=$\frac{{c(C{r_2}O_7^{2-})}}{{{c^2}(CrO_4^{2-})×{c^2}({H^+})}}$;
②酸化后所得溶液中c(Cr2O72-)=0.25 mol•L-1;
③已知:常温时该反应的平衡常数K=1014.上述酸化后所得溶液的pH=6.
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol•L-1以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于2.4×10-4mol•L-1,后续废水处理方能达到国家排放标准.
②还原法:CrO42-$→_{H+}^{l绿矾}$Cr3+$\stackrel{石灰水}{→}$Cr(OH)3.写出酸性条件下CrO42-与绿矾反应的离子方程式CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O.
分析 (1)根据流程图可知,煅烧过程中,铬铁矿中的Al2O3与纯碱反应生成了CO2,然后依据元素守恒配平,得化学方程式.
(2)①酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,据此写出K的表达式;
②根据守恒列关系式:2Cr~2CrO42-~Cr2O72-,列式计算得n(Cr2O72-)和n(CrO42-)剩余,进而求出酸化后所得溶液中c(Cr2O72-);
③根据反应 2CrO42-+2H+═?Cr2O72-+H2O及平衡常数K═1014,可求出c(H+)=1.0×10-6mol,则PH=6,
(3)①根据沉淀溶解平衡CrO42-+Ba2+?BaCrO4及Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=1.2×10-10,可得C(Ba2+);
②酸性条件下CrO42-与亚铁离子反应生成Cr3+和Fe3+、水.
解答 解:(1)根据流程图可知,煅烧过程中,铬铁矿中的Al2O3与纯碱反应生成了CO2,然后依据元素守恒配平,得化学方程式为Al2O3+Na2CO3$\frac{\underline{\;煅烧\;}}{\;}$2NaAlO2+CO2↑,
故答案为:Al2O3+Na2CO3$\frac{\underline{\;煅烧\;}}{\;}$2NaAlO2+CO2↑.
(2)①酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,其K的表达式为K=$\frac{{c(C{r_2}O_7^{2-})}}{{{c^2}(CrO_4^{2-})×{c^2}({H^+})}}$;
故答案为:$\frac{{c(C{r_2}O_7^{2-})}}{{{c^2}(CrO_4^{2-})×{c^2}({H^+})}}$;
③若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有$\frac{10}{11}$转化为Cr2O72-,说明铬元素有$\frac{10}{11}$转化为Cr2O72-
根据守恒列关系式:2Cr~2CrO42-~Cr2O72-
2 1
$\frac{28.6×\frac{10}{11}}{52}$mol n(Cr2O72-)
则n(Cr2O72-)=0.25mol,n(CrO42-)剩余=0.05mol;
则①酸化后所得溶液中c(Cr2O72-)=$\frac{n}{V}$=0.25mol•L-1;
故答案为:0.25mol•L-1;
②设H+的物质的量浓度为amol/L,
2CrO42-+2H+?Cr2O72-+H2O
平衡(mol/L) 0.05 a 0.25
平衡常数K=$\frac{0.25}{0.0{5}^{2}×{a}^{2}}$═1014,
则a=1.0×10-6mol,PH=6,
故答案为:6;
(3)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol•L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,
C(Ba2+)=2.4×10-4mol/L
故答案为2.4×10-4mol/L;
②酸性条件下CrO42-与亚铁离子反应生成Cr3+和Fe3+、水,其反应的离子方程式为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O;
故答案为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O.
点评 本题考查了物质的分离提纯流程,主要考查了操作流程分析、离子检验、金属的冶炼、溶度积常数的计算、方程式的书写等,题目难度中等,侧重于考查学生分析问题、解决问题能力和计算能力.

| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |

已知:2H2SO4(浓)+FeTiO3=TiOSO4+FeSO4+2H2O
(1)步骤I中发生反应的离子方程式:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O.

(2)已知:TiO2+易水解,只能存在于强酸性溶液中.25℃时,难溶电解质溶解度(s)与pH关系如图1,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀.
②TiO2+水解的离子方程式为TiO2++2H2O?TiO(OH)2+2H+.
向溶液II中加入Na2CO3粉末的作用是调节溶液pH值,促进TiO2+水解.当溶液pH接近3时,TiO(OH)2已沉淀完全.
(3)TiCl4$\stackrel{Mg}{→}$Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| A. | CH4分子的比例模型: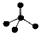 | B. | 氯原子的结构示意图: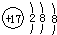 | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CS2结构式:S=C=S |
| X | ||
| Y | ||
| Z |
| A. | X是活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是最活泼的非金属元素,不存在最高价氧化物的水化物 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | X、Y、Z的单质中Z的熔点最高 |
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |

 300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示:
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式如图所示:
 .
.