题目内容
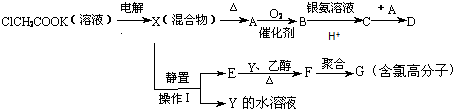
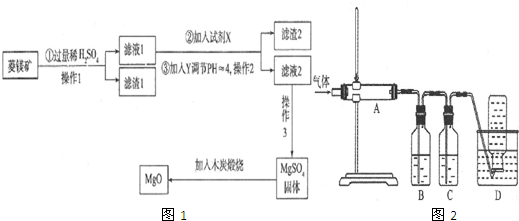
4.某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化.
请回答下列问题.
(1)操作I的名称是过滤.
(2)E的化学式为NH3.H2O、(NH4)2SO4.
(3)写出沉淀C→溶液的离子方程式Al2O3+2OH-=2AlO2-+H2O.
分析 某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,将A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤,得到的滤液中含有Al2(SO4)3,滤渣C为Al2O3和Fe2O3,向C中加入NaOH溶液,发生反应Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反应,过滤得到滤渣D为Fe2O3,滤液中含有NaOH和NaAlO2,向滤液中加入适量HCl,过滤得到NaCl溶液,沉淀Al(OH)3,将沉淀灼烧得到固体B为Al2O3,
向硫酸铝溶液中加入过量氨水得到沉淀Al(OH)3,滤液E中溶质为NH3.H2O、(NH4)2SO4;
结合题目分析解答.
解答 解:某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,将A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤,得到的滤液中含有Al2(SO4)3,滤渣C为Al2O3和Fe2O3,向C中加入NaOH溶液,发生反应Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反应,过滤得到滤渣D为Fe2O3,滤液中含有NaOH和NaAlO2,向滤液中加入适量HCl,过滤得到NaCl溶液,沉淀Al(OH)3,将沉淀灼烧得到固体B为Al2O3,
向硫酸铝溶液中加入过量氨水得到沉淀Al(OH)3,滤液E中溶质为NH3.H2O、(NH4)2SO4;
(1)分离难溶性固体和溶液采用过滤方法,所以操作I的名称是过滤,故答案为:过滤;
(2)E的化学式为NH3.H2O、(NH4)2SO4,故答案为:NH3.H2O、(NH4)2SO4;
(3)C是氧化铝,氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查混合物的分离和提纯,为高频考点,明确物质的性质是解本题关键,知道每个过程发生的反应及溶液中的溶质、沉淀成分,知道常见物质分离提纯方法,题目难度不大.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 碘的升华 | B. | 碘化银用于人工降雨 | ||
| C. | 液溴的气化 | D. | 漂白粉久置失效 |

(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol相关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是0.03mol)L.s)
(2)压强为p1时,向体积为1L密闭容器中充入bmolCO和2bmolH2,发生反应CO(g)+2H2(g)?CH3OH(g)
,平衡时CO的转化率与温度、压强的关系如图1所示,请回答:
①该反应属于放(填“吸”或“放”)热反应,p1<p2(填“>”“<”或“=”)
②100℃时,该反应的平衡常数K=$\frac{1}{{b}^{2}}$(用含b的代数式表示)
(3)治理汽车尾气的反应是2NO(g)+2CO(g)?2CO2+N2(g)在常温下能够自发进行,则它的△H<0.(填>、<).在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应,下列图象说明反应在进行到t1时刻一定达到平衡状态的是cd(选填字母)
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 在常温常压下,C4H10是气体 |
| A. | 氨气: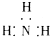 | B. | 四氯化碳: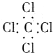 | C. | 氮气: | D. | 二氧化碳: |
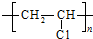 .
. .
.
 ;反应类型加聚反应.
;反应类型加聚反应.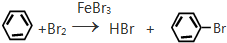 ;反应类型取代反应.
;反应类型取代反应.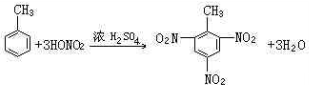 ;反应类型硝化反应(取代反应).
;反应类型硝化反应(取代反应).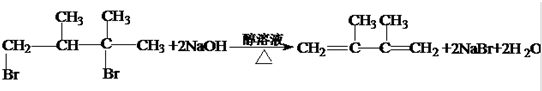 ;反应类型消去反应.
;反应类型消去反应.