题目内容
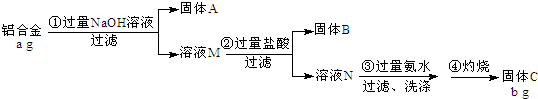
1.工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝.工艺流程如图:
(1)原料A的名称是盐酸,步骤①反应的离子方程式Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O.
(2)滤液1中要加入稍过量原料B,原料B的化学式是NaOH,步骤②的离子方程式是:H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O.
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,则会使最后加热获得的氧化铝含有SiO2(填化学式)杂质.
分析 石灰石煅烧得到CaO和CO2,向滤液2中加入足量石灰石煅烧产物之一,得到沉淀,加热沉淀得到氧化铝,则该沉淀为Al(OH)3,CO2通入偏铝酸盐溶液中得到Al(OH)3,所以原料B为强碱溶液,A为盐酸溶液,铝土矿中加入足量HCl,Al2O3、Fe2O3和稀盐酸反应生成AlCl3、FeCl3,SiO2不溶于稀盐酸,然后采用过滤方法得到残渣SiO2,滤液1中含有HCl、AlCl3、FeCl3,向滤液中加入足量NaOH溶液,AlCl3、FeCl3分别生成NaAlO2、Fe(OH)3,采用过滤方法得到沉淀Al(OH)3,滤液2中含有NaAlO2,向NaAlO2通入过量二氧化碳,生成Al(OH)3和NaHCO3,过滤得到的滤液3中溶质为NaHCO3,
(1)原料A的名称是稀盐酸,步骤①中氧化铝、氧化铁和稀盐酸反应生成盐和水;
(2)滤液1中要加入稍过量原料B,原料B的化学式是NaOH,酸和铁离子、铝离子和氢氧根离子反应;
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,二氧化硅和NaOH反应生成可溶性的硅酸钠,硅酸钠和二氧化碳反应生成沉淀硅酸,硅酸受热分解生成二氧化硅.
解答 解:石灰石煅烧得到CaO和CO2,向滤液2中加入足量石灰石煅烧产物之一,得到沉淀,加热沉淀得到氧化铝,则该沉淀为Al(OH)3,CO2通入偏铝酸盐溶液中得到Al(OH)3,所以原料B为强碱溶液,A为盐酸溶液,铝土矿中加入足量HCl,Al2O3、Fe2O3和稀盐酸反应生成AlCl3、FeCl3,SiO2不溶于稀盐酸,然后采用过滤方法得到残渣SiO2,滤液1中含有HCl、AlCl3、FeCl3,向滤液中加入足量NaOH溶液,AlCl3、FeCl3分别生成NaAlO2、Fe(OH)3,采用过滤方法得到沉淀Al(OH)3,滤液2中含有NaAlO2,向NaAlO2通入过量二氧化碳,生成Al(OH)3和NaHCO3,过滤得到的滤液3中溶质为NaHCO3,
(1)原料A的名称是稀盐酸,步骤①中氧化铝、氧化铁和稀盐酸反应生成盐和水,离子方程式分别为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,
故答案为:盐酸;Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O;
(2)滤液1含有HCl、AlCl3、FeCl3,要加入稍过量原料B,原料B的化学式是NaOH,酸和铁离子、铝离子和氢氧根离子反应,离子反应方程式为H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
故答案为:NaOH;H++OH-=H2O;Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,后续操作不变,二氧化硅和NaOH反应生成可溶性的硅酸钠,硅酸钠和二氧化碳反应生成沉淀硅酸,硅酸受热分解生成二氧化硅,所以得到的固体中还含有SiO2,故答案为:SiO2.
点评 本题考查物质分离和提纯,为高频考点,明确物质的性质是解本题关键,知道流程图中发生的反应、操作方法及溶液中的溶质,注意氧化铝的两性,注意滤液1中还含有HCl、滤液2中还含有NaOH.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | HCl | B. | Na2O2 | C. | N2H4 | D. | CH4 |
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |

(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C $\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;800℃-900℃\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 TiCl4+O2.已知相关数据如下:
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
(5)钛铁矿转化为粗TiO2也可以通过湿法完成:先用浓H2SO4溶解,将钛铁矿转化为TiO2+,然后使其水解得到粗TiO2.用酸清洗可除去粗TiO2中的Fe(OH)3杂质,已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下,Fe(OH)3(s)+3H+(aq)?Fe3+(aq)+3H2O(1)的平衡常数K=2.79×103.
(6)金属钛还可以通过电解直接获得.以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为TiO2+4e-=Ti+2O2-.
(1)用氨水捕集烟气中的CO2生成铵盐,是减少CO2排放的可行措施之一.
①写出氨水捕集烟气中的CO2生成铵盐的主要化学方程式CO2+NH3•H2O═NH4HCO3.
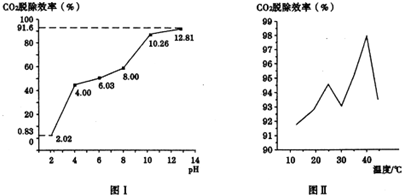
②分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图Ⅰ所示,CO2脱除效率与吸收剂的pH关系是CO2脱除效率随吸收剂的pH增大而增大.烟气中CO2的含量为12%,烟气通人氨水的流量为0.052m3/h(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量为0.13mol(精确到0.01).
③CO2脱除效率与温度的关系如图Ⅱ所示.从40℃到45℃脱除CO2效率降低的主要原因是碳酸氢铵受热易分解生成二氧化碳.
(2)将CO2和甲烷重整制合成气(CO和H2)是CO2资源化利用的有效途径.合成气用于制备甲醇的反应为
2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol.
①在T℃时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投人反应物,测得反应达到平衡时的有关数据如下.
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.|x|+|y|<90.1 C.2p2<p3 D.a1+a3<1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若甲容器中反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数为44.4%(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
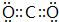
(2)写出⑨的原子结构示意图
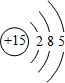 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式为
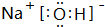 含有化学键为离子键、共价键
含有化学键为离子键、共价键(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;形成两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到(11)的元素中,Cl原子半径最小.
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |