13.下列指定反应的离子方程式正确的是( )
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
12.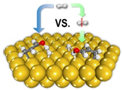 2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
 2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )| A. | 由氢原子构成的氢气分子只有一种 | |
| B. | 通常情况下,气体中氢气的密度最小 | |
| C. | 氢气可用于生产盐酸、氨气等化工产品 | |
| D. | 目前,工业上不采用电解水的方法大量生产氢气 |
11. 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
10.(多项选择题)下列说法中正确的是( )
| A. | SO3、NO3-、BF3都是平面三角型 | B. | P4、CS2、PH3都是非极性分子 | ||
| C. | 金刚石、石墨、SiC都是原子晶体 | D. | 第一电离能:N>O>C |
8.(多项选择题)下列有机物分子中的所有碳原子一定在同一平面上的是( )
| A. | 乙苯 | B. | 反-2-丁烯 | C. | 环己烷 | D. | 对二甲苯 |
4.将洁净的金属片放置在浸有某种溶液的滤纸上面并压紧(如图所示).下列有关说法正确的是( )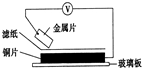
0 168215 168223 168229 168233 168239 168241 168245 168251 168253 168259 168265 168269 168271 168275 168281 168283 168289 168293 168295 168299 168301 168305 168307 168309 168310 168311 168313 168314 168315 168317 168319 168323 168325 168329 168331 168335 168341 168343 168349 168353 168355 168359 168365 168371 168373 168379 168383 168385 168391 168395 168401 168409 203614

| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
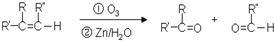
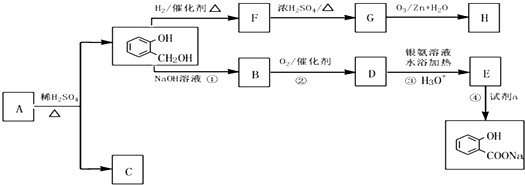
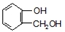 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验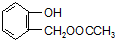 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.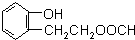 和
和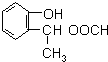 (不考虑立体异构).
(不考虑立体异构). .
.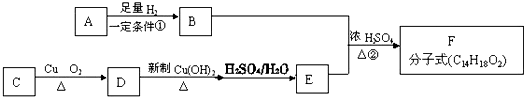
 或
或 或
或 ;
; .
. 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
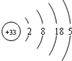
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.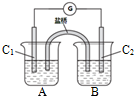 已知砷(As)元素的原子结构示意图为
已知砷(As)元素的原子结构示意图为