题目内容
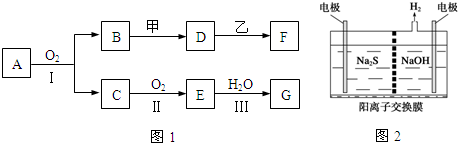
6. 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.试回答:
(1)以辛烷(C8H18)代表汽油,写出该电池工作时负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(2)石油催化裂化的主要目的是提高轻质油(汽油)的产量.
(3)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O $\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a(填字母序号),反应b中理论上原子利用率为46%.
分析 (1)电解质能在高温下能传导O2-,负极发生氧化反应,即C8H18)失去电子生成CO2,根据质量守恒和电荷守恒写出电极反应式;
(2)石油催化裂化的主要目的是提高轻质油(汽油)的产量;
(3)最节能的措施应使用太阳能;原子利用率等于期望产物的总质量与生成物的总质量之比.
解答 解:(1)电解质能在高温下能传导O2-,负极发生氧化反应,即1molC8H18失去电子生成CO2,共失去8×[+4-(-$\frac{18}{8}$)]=50mole-,18molH原子转化为9molH2O,根据质量守恒和电荷守恒写出电极反应为:C8H18-50e-+25O2-=8CO2+9H2O,故答案为:C8H18-50e-+25O2-=8CO2+9H2O;
(2)石油催化裂化的主要目的是提高轻质油(汽油)的产量,故答案为:提高轻质油(汽油)的产量;
(3)最节能的措施应使用太阳能;原子利用率等于期望产物的总质量与生成物的总质量之比,反应b中理论上原子利用率为:$\frac{46}{88+12}$×100%=46%,故答案为:a、46%;
点评 本题考查电极反应式的书写、石油催化裂化和原子的得用率,综合能力要求较高,特殊是第一小题有一定的难度.

练习册系列答案
相关题目
16.常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c( R2-)+c( HR- )=c( Na+ ) | |
| B. | 某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:c( Cl- )>c( NH4+ )>c( H+ )=c( OH- ) | |
| C. | 某物质的溶液中由水电离出的c ( H+ )=1×10-amol•L-1,若a>7,则溶液的pH一定为14-a | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2 c( OH- )+c( A- )=2 c( H+ )+c( HA ) |
14.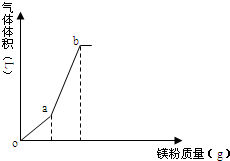 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |
11. 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形形.
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
18.有A、B、C、D四种原子序数依次增大的短周期元素,其中只有C为金属元素,A和C的最外层电子数相同,C和D的质子数之和是A和B质子数之和的3倍,D的氧化物是形成酸雨的主要气体,下列说法不正确的是( )
| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
15.将X mol的Cl2通入到60mL,10.00mol•L-1的浓NaOH溶液中,加热一段时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质,则下列分析合理的是( )
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
16.下列有关颜色变化错误的是( )
| A. | 在FeCl3溶液中滴入几滴KSCN溶液,溶液变成血红色 | |
| B. | 淡黄色溴化银见光分解后变成白色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程不考虑温度变化),气体颜色逐渐变深 |
 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.