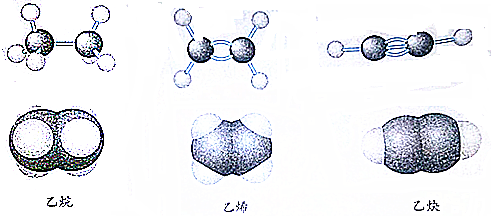
题目内容
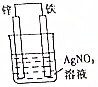
4.将洁净的金属片放置在浸有某种溶液的滤纸上面并压紧(如图所示).下列有关说法正确的是( )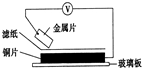
| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
分析 A、锌片为负极,电子从负极流向正极;
B、金属片为铁片,溶液为氯化钠,发生吸氧腐蚀;
C、铁比锡活泼,仍然腐蚀铁;
D、构成原电池两电极的金属活动性相差越大,电压表读数越大.
解答 解:A、锌片为负极,电子从负极流向正极,所以则电子由锌片流向铜片,故A错误;
B、金属片为铁片,溶液为氯化钠,发生吸氧腐蚀,正极发生氧化反应,电极反应式为:O2+2H2O+4e-═4OH-,故B正确;
C、铁比锡活泼,仍然腐蚀铁,故C错误;
D、构成原电池两电极的金属活动性相差越大,电压表读数越大,因为锌比铁活泼,所以伏特表“示数”接入锌片的大,故D正确;
故选BD.
点评 本题考查常见金属的活动性顺序的比较方法以及金属的电化学腐蚀及防护,题目难度中等,注意把握原电池的工作原理,注意加强对数据分析能力的培养.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
14.下列实验操作中,能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
15.将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
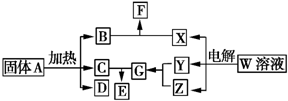 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.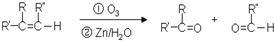
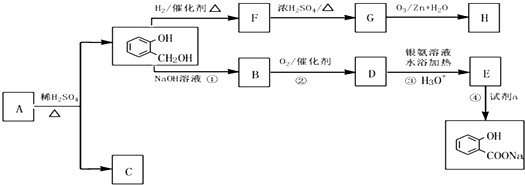
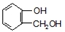 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验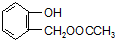 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.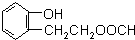 和
和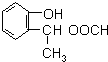 (不考虑立体异构).
(不考虑立体异构). .
.
 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.