题目内容
10.(多项选择题)下列说法中正确的是( )| A. | SO3、NO3-、BF3都是平面三角型 | B. | P4、CS2、PH3都是非极性分子 | ||
| C. | 金刚石、石墨、SiC都是原子晶体 | D. | 第一电离能:N>O>C |
分析 A.根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
B.正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,对于ABn型分子,中心原子A的最外层电子全部成键,为非极性分子,中心原子A的最外层电子部分成键,为极性分子;
C.原子晶体是原子之间通过共价键形成的晶体,常见的原子晶体有:一些非金属单质,如金刚石、硼、硅等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;
D.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素.
解答 解:A.三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,且不含孤电子对,所以为平面三角形结构,NO3-离子中价层电子对个数=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以为平面三角形结构,BF3中价电子对数为:$\frac{3+3}{2}$=3,形成3个共用电子对,无孤对电子.为平面三角型,故A正确;
B.P4为正四面体结构,结构对称为非极性分子,CS2中C最外层4个电子,成键个数为4,且不含孤电子对,正负电荷的重心重合,电荷分布均匀,为非极性分子,PH3中P最外层5个电子,成键个数为3,且含有一个孤电子对,正负电荷重心不重合,为极性分子,故B错误;
C.金刚石、SiC都是原子晶体,石墨属于混合晶体,故C错误;
D.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,故第一电离能顺序为:N>O>C,故D正确;
故选AD.
点评 本题考查分子空间构型判断、分子极性判断、原子晶体以及第一电离能大小比较等知识,明确价层电子对互斥理论为解答关键,题目难度中等.

| A. | c(CH3COO-)+c(NO3-)+c(OH-)=c(H+)+c(Na+) | |
| B. | c(CH3COO-)=c(Na+)=c(NO3-)>c(CH3COOH)>c(H+)>c(Na+) | |
| C. | c(CH3COO-)>c(NO3-)>c(CH3COOH)=c(Na+)>c(H+)>c(OH-) | |
| D. | c(Na+)>c(NO3-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br与NaOH溶液是否发生反应 | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液,加AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数为0.1NA | |
| C. | 32gO2和32g O3的所含的氧原子数都是为2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
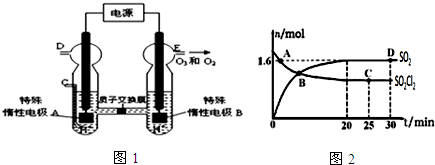
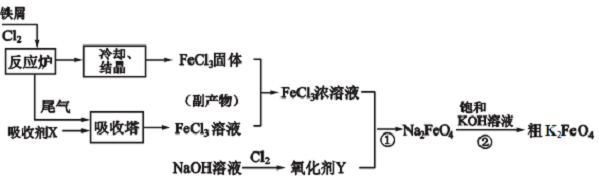
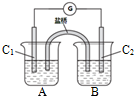
 ).
).
 .
. .
. .
. 、
、 、
、 .
.
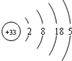
 已知砷(As)元素的原子结构示意图为
已知砷(As)元素的原子结构示意图为