题目内容
9.已知有机物分子中的碳碳双键发生臭氧氧化反应: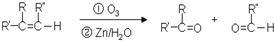
有机物A的相对分子质量Mr(A)是氢气相对分子质量的83倍.A遇FeCl3溶液显紫色,G的分子式为C7H12O,A~H均为有机物,其转化关系如图:
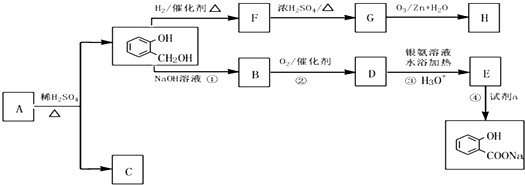
(1)下列说法正确的是ABD.
A.E的分子式是C7H6O3
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.由
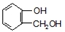 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验(2)A的结构简式为
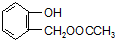 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.(3)反应①的作用是保护酚羟基,防止在反应②中被O2氧化,合适的试剂a为NaHCO3.
(4)同时满足下列条件的A的所有同分异构体的结构简式
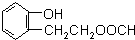 和
和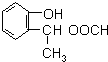 (不考虑立体异构).
(不考虑立体异构).Ⅰ.与A具有相同的官能团Ⅱ.属于苯的邻二取代物
Ⅲ.1H-NMR分析,分子中有8种不同化学环境的氢原子
(5)若H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银.写出H与足量的新制银氨溶液反应的化学方程式
 .
.
分析 A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与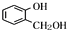 ,可知C含有羧基,则Mr(A)=83×2=166,
,可知C含有羧基,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为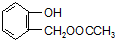 ,由转化关系可知,F为
,由转化关系可知,F为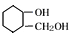 ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为 ,H为
,H为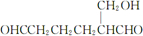 .
. 与氢氧化钠水溶液放出生成B为
与氢氧化钠水溶液放出生成B为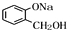 ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为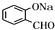 ,E为
,E为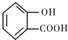 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到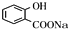 ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液.(6)中苯乙烯发生臭氧氧化得到苯甲醛与甲醛,苯甲醛发生催化氧化得到苯甲酸,甲醛与氢气发生加成反应生成甲醇,苯甲酸与甲醇发生酯化反应得到
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液.(6)中苯乙烯发生臭氧氧化得到苯甲醛与甲醛,苯甲醛发生催化氧化得到苯甲酸,甲醛与氢气发生加成反应生成甲醇,苯甲酸与甲醇发生酯化反应得到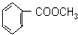 ,据此解答.
,据此解答.
解答 解:A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与 ,可知C含有羧基,则Mr(A)=83×2=166,
,可知C含有羧基,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为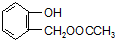 ,由转化关系可知,F为
,由转化关系可知,F为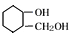 ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成4mol单质银,则H中含有2个-CHO,则亚甲基上的-OH不能发生消去反应,可推知G为 ,H为
,H为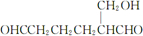 .
. 与氢氧化钠水溶液放出生成B为
与氢氧化钠水溶液放出生成B为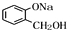 ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为 ,E为
,E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到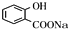 ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
(1)A.E为 ,分子式是C7H6O3,故A正确;
,分子式是C7H6O3,故A正确;
B.A为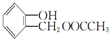 ,酯基、酚羟基与氢氧化钠反应,1mol A最多可以和2mol NaOH反应,故B正确;
,酯基、酚羟基与氢氧化钠反应,1mol A最多可以和2mol NaOH反应,故B正确;
C.C为CH3COOH,可以发生氧化反应、取代反应,不能发生加成反应,故C错误;
D.由 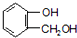 到F反应中苯环与氢气发生加成反应,反应中酚羟基转化为醇羟基,可用FeCl3溶液检验是否进行完全,故D正确,
到F反应中苯环与氢气发生加成反应,反应中酚羟基转化为醇羟基,可用FeCl3溶液检验是否进行完全,故D正确,
故答案为:ABD;
(2)由上述分析可知,A的结构简式为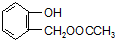 ,由上述发生可知F到G的反应类型为 消去反应,
,由上述发生可知F到G的反应类型为 消去反应,
故答案为: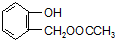 ;消去反应;
;消去反应;
(3)反应①的作用是:是保护酚羟基,防止在反应②中被氧化,合适的试剂a为NaHCO3溶液,
故答案为:保护酚羟基,防止在反应②中被氧化;NaHCO3溶液;
(4)同时满足下列条件的A(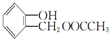 )的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,Ⅲ.1H-NMR分析,分子中有8种不同化学环境的氢原子,苯环与酚羟基含有5种H原子,则另外侧链含有3种H原子,故另外侧链为-CH2CH2OOCH,-CH(CH3)OOCH,结构简式为:
)的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.属于苯的邻二取代物,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,Ⅲ.1H-NMR分析,分子中有8种不同化学环境的氢原子,苯环与酚羟基含有5种H原子,则另外侧链含有3种H原子,故另外侧链为-CH2CH2OOCH,-CH(CH3)OOCH,结构简式为: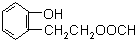 和
和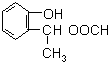 ,
,
故答案为: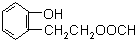 和
和 ;
;
(5)H的结构简式为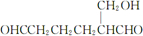 ,与足量的新制银氨溶液反应的化学方程式为
,与足量的新制银氨溶液反应的化学方程式为 ,
,
故答案为: ;
;
点评 本题考查有机物推断与合成,难度中等,关键是根据相对分子质量综合分析确定C为乙酸,再根据反应条件进行推断,对学生的分析推理有一定的要求,需要学生熟练掌握官能团的性质与转化.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物年代的鉴定,${\;}_{\;}^{14}$C与${\;}_{\;}^{12}$C互为同素异形体 |
| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
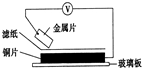
| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
| A. | 反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应的△H<0 | |
| B. | 铅蓄电池放电时反应为:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、负极质量均减小 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,充分搅拌后过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
 .
.