题目内容
11. 现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大.请根据表中相关信息,回答问题.| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
(2)E在周期表的位置是第四周期第IB族,位于ds区,其基态原子有29种运动状态.
(3)BC3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验D元素的方法是焰色反应.
(4)E单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示.则晶胞中该原子的配位数为12,E单质晶体中原子的堆积方式为四种基本堆积方式中的面心立方堆积.若已知E的原子半径为d cm,NA代表阿伏加德罗常数,E的相对原子质量为M,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
分析 A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,其电子排布为:1s22s22p3,则A为N元素;B原子核外所有p轨道全满或半满,则价电子为3s23p3符号题意,则B为P元素;C元素的主族序数与周期数的差为4,C为第三周期第ⅤⅡA族元素,即C为Cl元素;D、E为第四周期元素,它们的原子序数依次增大,D是前四周期中电负性最小的元素,则D为K元素;E在周期表的第11列,则E位于第四周期第IB族,为Cu元素,然后利用原子结构及分子的空间构型来解答.
解答 解:A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,其电子排布为:1s22s22p3,则A为N元素;B原子核外所有p轨道全满或半满,则价电子为3s23p3符号题意,则B为P元素;C元素的主族序数与周期数的差为4,C为第三周期第ⅤⅡA族元素,即C为Cl元素;D、E为第四周期元素,它们的原子序数依次增大,D是前四周期中电负性最小的元素,则D为K元素;E在周期表的第11列,则E位于第四周期第IB,为Cu元素,
(1)A为N元素,N的基态原子中能量最高的电子为2p电子,其电子云在空间有x、y、z三个方向;p轨道呈纺锤形,
故答案为:3;纺锤形;
(2)E为Cu原子,原子序数为29,位于周期表中第四周期第IB族,位于周期表中的ds区,铜原子的核外电子总数为29,所以其基态原子有29种不同的运动状态,
故答案为:第四周期第IB族;ds;29;
(3)BC3为PCl3,其中心原子P形成了3个单键,还存在1对孤对电子,则其杂化轨道数为4,采用sp3;由于三氯化磷分子中含有1对孤对电子,则其空间构型为三角锥形;D为K元素,检验钾元素可以通过焰色反应检验,
故答案为:sp3;三角锥形;焰色反应;
(4)E为Cu元素,由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12;该单质晶体中原子的堆积方式为面心立方堆积,结合乙图可知,晶胞的边长为$\frac{\sqrt{2}}{2}$×4dcm=2$\sqrt{2}$dcm,所以晶胞的体积为(2$\sqrt{2}$dcm)3=16$\sqrt{2}$d3cm3,根据均摊法可知,每个晶胞中含有的原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以晶胞的密度为:$\frac{\frac{4×M}{{N}_{A}}g}{16\sqrt{2}{d}^{3}c{m}^{3}}$=$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3,
故答案为:12;面心立方堆积;$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题考查位置、结构、性质的关系及其应用,题目难度较大,推断各元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,(4)为难点,注意掌握晶胞计算的方法与技巧.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |
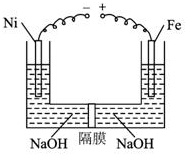 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
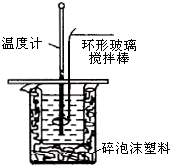 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)NaOH溶液稍过量的原因确保硫酸被完全中和.
(2)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l);△H=-113.7kJ•mol-1.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
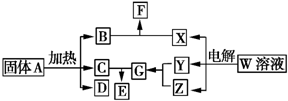 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键. 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.