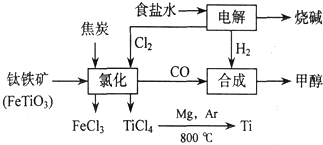
13.化学与社会、生活密切相关.如表中的事实和解释均正确的是( )
| 选项 | 事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可作为油脂分解的催化剂 |
| B | 铝罐车可用于运输稀硝酸 | 铝表面形成致密氧化膜具有保护作用 |
| C | 甘油作为化妆品中的保湿剂 | 甘油易与水形成氢键 |
| D | 氢氟酸刻蚀水晶工艺品 | HF具有强酸性 |
| A. | A | B. | B | C. | C | D. | D |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
11.汽车排气管加装催化装置,可有效减少CO和NOx的排放.催化装置内发生的反应为:NOx+CO→N2+CO2,下列说法一定正确的是( )
| A. | 上述氧化物均为酸性氧化物 | |
| B. | 反应中既有极性键也有非极性键形成 | |
| C. | 当x=2时,转移的电子数为4×6.02×1023 | |
| D. | 该反应为置换反应 |
8.下列实验装置、试剂选用或操作正确的是( )
| A. | 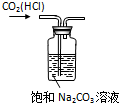 除CO2中的HCl | B. | 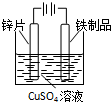 铁制品上镀锌 | C. |  吸收氨气 | D. |  制备少量O2 |
7.浓度均为0.1mol/L的五种溶液:①CH3COOH ②Ba(OH)2 ③CH3COONa ④NaOH ⑤Na2CO3中,由水电离出的c(H+)按由小到大的排列正确的是( )
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
4.76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降( )
0 168213 168221 168227 168231 168237 168239 168243 168249 168251 168257 168263 168267 168269 168273 168279 168281 168287 168291 168293 168297 168299 168303 168305 168307 168308 168309 168311 168312 168313 168315 168317 168321 168323 168327 168329 168333 168339 168341 168347 168351 168353 168357 168363 168369 168371 168377 168381 168383 168389 168393 168399 168407 203614
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
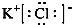 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).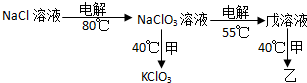
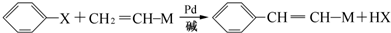
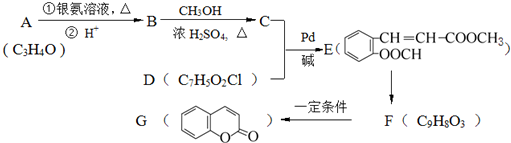

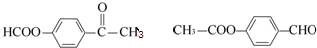
 )常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液
)需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液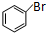 +CH2═CHCOOCH3$→_{碱}^{Pd}$
+CH2═CHCOOCH3$→_{碱}^{Pd}$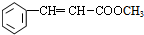 +HBr.
+HBr.