题目内容
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
分析 将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大,说明正反应是放热反应,所以反应在恒温恒容的密闭容器中进行,两边的气体物质的量相等,所以容器内压强始终不变,由此分析解答.
解答 解:A、两边的气体物质的量相等,平衡前,随着反应的进行,容器内压强始终不变,故A正确;
B、D是固体,量变但浓度不变,平衡不移动,故B错误;
C、正反应是放热反应,升高温度平衡逆向移动,气体质量增加,容器内混合气体的密度增大,故C错误;
D、平衡常数是温度的函数,温度不变K不变,故D错误;
故选A.
点评 本题考查化学平衡移动,侧重于学生的分析能力的考查,注意把握反应的特点,结合方程式以及影响因素解答该题,难度不大

练习册系列答案
相关题目
3.50mL BaCl2溶液和20mL0.5mol/L的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
20.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
7.浓度均为0.1mol/L的五种溶液:①CH3COOH ②Ba(OH)2 ③CH3COONa ④NaOH ⑤Na2CO3中,由水电离出的c(H+)按由小到大的排列正确的是( )
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
17. 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
4.将洁净的金属片放置在浸有某种溶液的滤纸上面并压紧(如图所示).下列有关说法正确的是( )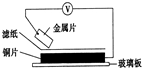

| A. | 若金属片为锌片,溶液为稀硫酸,则电子由铜片流向锌片 | |
| B. | 若金属片为铁片,溶液为氯化钠,则正极发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 若金属片为铁片,溶液为氯化钠,为防止铁片发生吸氧腐蚀,可以将铜片换成锡片 | |
| D. | 若滤纸浸有盐溶液,金属片分别用锌片和铁片接入,伏特表“示数”接入锌片的大 |
1.常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
2.下列有关化学用语表示正确的是( )
| A. | NaOH的电子式: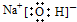 | |
| B. | 质子数和中子数均为16的硫原子:1616S | |
| C. | 氟原子的结构示意图: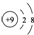 | |
| D. | 乙醛的结构简式: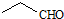 |