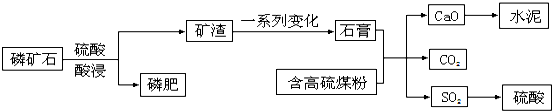
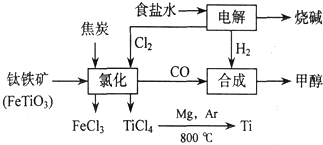
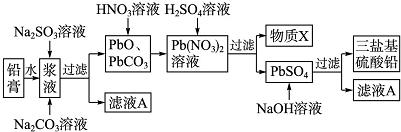
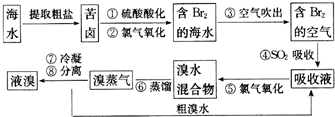
题目内容
10.(1)某温度下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g),△H=-98kJ/mol.开始时在100L密闭容器中加入4.0molSO2和10.0molO2,当反应达到平衡时,共放出196KJ热量.该反应的平衡常数为K=3.33.(2)有一种甲醇燃料电池,采用NaOH作电解质溶液,写出该电池负极反应式CH3OH-6e-+8OH-═CO32-+6H2O;用该电池做电源,石墨为电极电解氯化镁溶液,阴极现象为有无色气体产生,同时生成白色沉淀.
分析 (1)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(2)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇燃烧生成碳酸根离子;用石墨电极电解氯化镁溶液,阴极上氢离子放电,溶液显碱性.
解答 解:(1)由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1,
在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,则消耗SO2 2mol,
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
起始 4.0mol 10.0mol 0
转化:2mol 1.0mol 2.0mol
平衡:2.0mol 9.0mol 2.0mol
则平衡时:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L,
所以k=$\frac{c(S{O}_{3})}{c(S{O}_{2})•\sqrt{c({O}_{2})}}$=$\frac{0.02mol/L}{0.02mol/L×\sqrt{0.09mol/L}}$=3.33,
故答案为:3.33;
(2)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲醇在负极生成碳酸根离子,故a应该通入甲醇,其电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O;
用石墨电极电解氯化镁溶液,阴极上氢离子放电生成氢气,溶液显碱性遇镁离子生成白色沉淀,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;有无色气体产生,同时生成白色沉淀.
点评 本题考查了化学平衡常数的计算、原电池和电解池知识,综合性较强,注意细心思考,细心计算.

| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
| A. | 2:3 | B. | 1:3 | C. | 4:3 | D. | 3:2 |
| A. | 溶液、胶体、浊液三种分散系可用丁达尔效应进行区分 | |
| B. | △H<0且△S>0的反应可以自发进行 | |
| C. | 酸碱中和滴定实验中装标准液的滴定管未润洗,会造成所测结果偏低 | |
| D. | 钢铁吸氧腐蚀的负极反应为:O2+4e-+2H2O═4OH- |
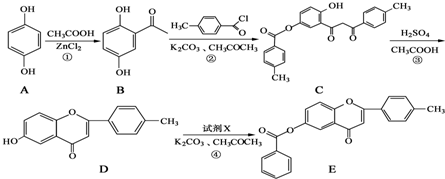
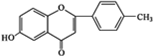 +
+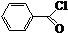 $\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$
$\stackrel{K_{2}CO_{3}、CH_{3}COCH_{3}}{→}$ +HCl.
+HCl.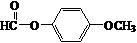 .
.