题目内容
4.76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降( )| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
分析 方法一:设参加反应的H+物质的量为x,依据化学方程式定量关系Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O计算.
方法二:根据溶液中电荷守恒分析,溶液中减少的正电荷等于减少的负电荷,则n(H+)=2n(Cu2+)+n(NO3-).
解答 解:方法一:设生成的NO2为mol,生成的NO为ymol,
已知Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
据关系式Cu-----4H+-----2NO2-----2NO3-(减少的)
1mol 4mol 2mol
$\frac{x}{2}$mol 2x xmol
已知3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
据关系式3Cu-----8H+-----2NO-----2NO3-(减少的)
3mol 8 mol 2mol
$\frac{3}{2}$ymol 4ymol ymol
则:$\frac{x}{2}$mol+$\frac{3}{2}$ymol=$\frac{76.8×1{0}^{-3}g}{64g/mol}$,xmol+ymol=2×10-3mol,
解得:x=1.8×10-3mol,y=2×10-4mol,
则溶液中H+同时下降2x+4y=4.4×10-3mol,
方法二:根据溶液中电荷守恒可知:溶液中减少的正电荷等于减少的负电荷,则n(H+)=2n(Cu2+)+n(NO3-)=$\frac{76.8×1{0}^{-3}g}{64g/mol}$×2+2×10-3mol=4.4×10-3mol;
故选C.
点评 本题考查了化学方程式计算分析应用,注意反应过程分析判断,硝酸根离子减小量使做氧化剂的硝酸的量,掌握基础是关键,题目较简单.

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 胶体 | B. | 悬浊液 | C. | 溶液 | D. | 乳浊液 |
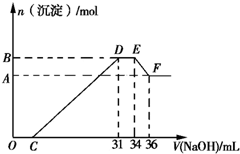 硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | 反应中硝酸的还原产物为NH4+ | |
| B. | DE段反应的离子方程式为:NH4++OH-═NH3•H2O | |
| C. | 合金中铁和铝的物质的量之比为1:3 | |
| D. | 图象中C点所加NaOH溶液的体积为7mL |
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
| A. | 5.4g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| B. | 5.35g NH4Cl固体中含有的N-H键个数为0.4NA | |
| C. | 将含有1mol FeCl3的浓溶液全部制成胶体,含Fe(OH)3胶粒的数目为NA | |
| D. | 120g熔融的NaHSO4中含阳离子总数为2NA |
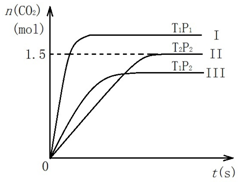 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )| A. | 温度T2>T1 | B. | 压强P2>P1 | ||
| C. | II曲线表示NO平衡转化率为25% | D. | 该反应的焓变△H<0 |
| A. | 用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| B. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O | |
| C. | NH4Al(SO4)2溶液与过量NaOH溶液混合加热:NH4++Al3++4OH-═Al(OH)3↓+NH3↑+H2O | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-═2Mn2++5SO42-+2H2O |
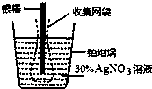 下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )
下图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法正确的是( )| A. | 电量计工作时溶液里的阴离子向正极移动 | |
| B. | 电量计工作时银棒应与电源的正极相连 | |
| C. | 网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏低 | |
| D. | 若得金属银的沉积量为1.08g,则电解过程中转移的电子为0.01mol |
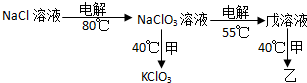
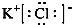 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).