题目内容
5.钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.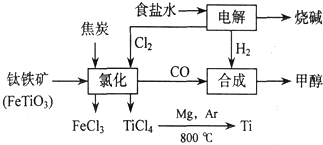
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO.
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=-641kJ/mol;②Ti(s)+2Cl2(g)=TiCl4(s);△H=-770kJ/mol.下列说法正确的是C.
A.Mg的燃烧热为641kJ/mol
B.Ti的能量一定比TiCl4高
C.等质量的Mg(s)、Ti(s)与足量的氯气反应,前者放出的热量多
D.该冶炼Ti法对环境友好
(4)在上述产业链中,合成192t甲醇理论上需额外补充H210 t(不考虑生产过程中物质的任何损失).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是CH3OH-6e-+8OH-=CO32-+6H2O.
分析 由图可知,电解饱和食盐水生成NaOH、氢气、氯气,氢气与CO合成甲醇,氯气、C与钛铁矿发生氧化还原反应,Mg还原TiCl4得到Ti,
(1)电解食盐水生成NaOH、H2和Cl2,以此书写离子方程式;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式;
(3)A.1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热;
B.反应热为反应物总能量与生成物总能量的差值;
C.物质的量与反应放出的热量成正比;
D.由图可知,转化过程中存在有毒气体的参与.
(4)根据CO+2H2→CH3OH、2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO、2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑可知CH3OH~CO~$\frac{7}{6}$Cl2~$\frac{7}{6}$H2,以此计算;
(5)碱性甲醇电池中,甲醇在负极上失电子发生氧化反应.
解答 解:由图可知,电解饱和食盐水生成NaOH、氢气、氯气,氢气与CO合成甲醇,氯气、C与钛铁矿发生氧化还原反应,Mg还原TiCl4得到Ti,
(1)电解食盐水生成NaOH、H2和Cl2,反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO;
(3)A.Mg不是在O2中燃烧,故641kJ/mol不能称其燃烧热,故A错误;
B.反应Ti(s)+2Cl2(g)=TiCl4(s)为放热反应,1mol Ti(s)和2mol Cl2 (g)的总能量大于1mol TiCl4 (s)的总能量,故B错误;
C.假设质量均为24g,则Mg(s)与足量Cl2(g)反应放出641kJ热量,24gTi(s) 与足量Cl2(g)反应放出的热量=$\frac{24g}{48g/mol}$×770kJ=385kJ,故C正确;
D.该冶炼Ti法,氯气、CO等均看污染环境,不符合对环境友好,故D错误;
故答案为:C;
(4)根据CO+2H2→CH3OH、2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO、2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑可知,CH3OH~CO~$\frac{7}{6}$Cl2~$\frac{7}{6}$H2,所以生产1 molCH3OH,理论上还需补充氢气(2-$\frac{7}{6}$)mol=$\frac{5}{6}$mol,即$\frac{5}{3}$gH2,故生产192 t CH3OH还需补充H2的质量为$\frac{192}{32}$×$\frac{5}{3}$=10t,
故答案为:10;
(5)碱性甲醇电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查较为综合,侧重物质制备及分离提纯的综合考查,为高频考点,涉及离子方程式、化学反应与能量、电化学等知识,题目难度中等,(4)中关系式法计算为解答的难点.

| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓盐酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 浓硫酸 | 蔗糖 | 酸性KMnO4溶液 | 浓硫酸具有酸性、脱水性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在蒸馏水中加入大量NaOH固体,KW不变 | |
| B. | 0.1mol/LHF溶液的PH=2,则该溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
| A. | 反应2Mg(s)+CO2(g)═2MgO(s)+C(s)能自发进行,则该反应的△H<0 | |
| B. | 铅蓄电池放电时反应为:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、负极质量均减小 | |
| C. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,充分搅拌后过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
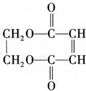 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: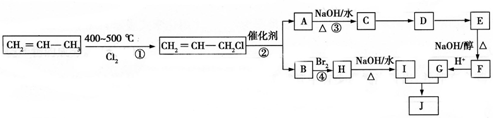
 ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
 ;其所含化学键类型为共价键、离子键;
;其所含化学键类型为共价键、离子键;