2.在恒温恒容的容器中进行反应H2?2H,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为( )
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
19.下列各组分子中,都属于含有极性键的非极性分子的是( )
| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |
18.下列有关晶体的说法正确的是( )
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
17.下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A. | CCl4 | B. | BeCl2 | C. | BF3 | D. | HClO |
16.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)F元素在周期表中的位置是第三周期第ⅢA族.
(2)分别写出BA4、EG的电子式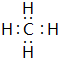 、
、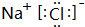
(3)用电子式表示离子化合物E2D、BD2的形成过程: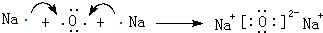 、
、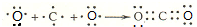
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
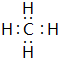 、
、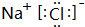
(3)用电子式表示离子化合物E2D、BD2的形成过程:
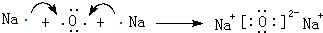 、
、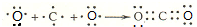
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
14.有一种保健食品含有人体所必须的硒元素,有一定的保健作用,已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述不正确的是( )
0 168098 168106 168112 168116 168122 168124 168128 168134 168136 168142 168148 168152 168154 168158 168164 168166 168172 168176 168178 168182 168184 168188 168190 168192 168193 168194 168196 168197 168198 168200 168202 168206 168208 168212 168214 168218 168224 168226 168232 168236 168238 168242 168248 168254 168256 168262 168266 168268 168274 168278 168284 168292 203614
| A. | 原子序数是24 | |
| B. | 最高价氧化物是SeO3,是酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物化学式是H2Se,稳定性比HCl差 |
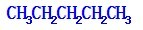 、
、 、
、 .
.