题目内容
15.(1)在${\;}_1^1$H,${\;}_1^2$H,${\;}_1^3$H,${\;}_{12}^{23}$Mg,${\;}_{12}^{24}$Mg,${\;}_8^{16}$O,${\;}_8^{17}$O,${\;}_8^{18}$O中共有3种元素,8种原子,中子数最多的是${\;}_{12}^{24}$Mg.D218O的相对分子质量是22.(2)写出戊烷的三种同分异构体
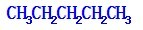 、
、 、
、 .
.
分析 (1)元素:核电荷数相同的一类原子的总称;
核素:具有一定数目质子和一定数目中子的原子;
中子数=质量数-质子数,依此进行判断;
(2)利用减链法书写同分异构体.
解答 解:(1)在${\;}_1^1$H,${\;}_1^2$H,${\;}_1^3$H,${\;}_{12}^{23}$Mg,${\;}_{12}^{24}$Mg,${\;}_8^{16}$O,${\;}_8^{17}$O,${\;}_8^{18}$O中共有共有氢、镁、氧3种元素,8种原子,
${\;}_1^1$HH的中子数为1-1=0,${\;}_1^2$H的中子数为2-1=1,${\;}_1^3$H的中子数为3-1=2,${\;}_{12}^{23}$Mg的中子数为23-12=11,${\;}_{12}^{24}$Mg的中子数为24-12=12,${\;}_8^{16}$O的中子数为16-8=8,${\;}_8^{17}$O的中子数为17-8=9,${\;}_8^{18}$O的中子数为18-8=10,故中子数最多的是${\;}_{12}^{24}$Mg;D218O的相对分子质量是2×2+18=22.
故答案为:3;8;${\;}_{12}^{24}$Mg;22;
(2)戊烷的三种同分异构体分别为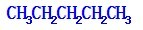 ,拿下1个碳原子作为支链为
,拿下1个碳原子作为支链为 ,拿下2个碳原子作为支链为
,拿下2个碳原子作为支链为 ,
,
故答案为: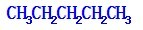 ;
; ;
; .
.
点评 本题考查元素、核素的概念、粒子间的数量关系计算、相对分子质量的相关计算以及同分异构体的书写等,难度不大,要注意基础知识的积累.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
5.某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
请回答下列问题:
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.
6.关于原子结构的叙述正确的是( )
| A. | 原子的次外层电子数都是2 | |
| B. | 稀有气体原子的最外层电子数均为8 | |
| C. | 原子的最外层电子数不超过8个 | |
| D. | 所有的原子核都是由质子和中子组成的 |
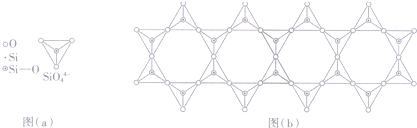
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
19.当前在人类已知的化合物中,品种最多的是( )
| A. | ⅤA 族元素的化合物 | B. | ⅢB族元素的化合物 | ||
| C. | 过渡元素的化合物 | D. | ⅣA 族元素的化合物 |
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.