题目内容
19.下列各组分子中,都属于含有极性键的非极性分子的是( )| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.HCl是由极性键构成的双原子极性分子,NH3为三角锥形结构,含有极性键,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故A错误;
B.BeCl2中Be-Cl键是不同元素形成的共价键,为极性键,两个Be-Cl键间的夹角为180°,说明分子是对称的,正电荷中心与负电荷的中心重合,BeCl2属于非极性分子,N2为直线形结构,含有非极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子,故B错误;
C.CH4和C2H4都含有C-H,是极性键,甲烷是正四面体结构,乙烯分子结构是平面对称型结构,二者正负电荷重心都能重合,都是非极性分子,故C正确;
D.CS2含有S=C,为极性键,二硫化碳是直线分子,呈对称结构,是非极性分子;H2O含有O-H,为极性键,水是V型分子,是极性分子,故D错误;
故选C.
点评 本题考查键的极性和分子的极性的判断,题目难度中等,注意共价键极性和分子极性的判断方法.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
9.100 mL 1 mol•L-1的盐酸与锌粒反应,下列措施能使反应速率加快的是( )
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
7.某烯烃C9H18与H2加成后的产物如图,则该烯烃的可能结构有( )
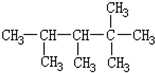

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.有一种保健食品含有人体所必须的硒元素,有一定的保健作用,已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述不正确的是( )
| A. | 原子序数是24 | |
| B. | 最高价氧化物是SeO3,是酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物化学式是H2Se,稳定性比HCl差 |
11.室温下,下列叙述正确的是( )
| A. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(${HCO}_{3}^{-}$)-c(${CO}_{3}^{2-}$) | |
| B. | pH=2是HA酸溶液与pH=12的MOH碱溶液等体积混合:c(M+)=c(OH-)>c(H+)=c(A-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水②10mL0.2mol/LMgCl2③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
3.除去FeCl2溶液中少量的FeCl3,最好的办法是( )
| A. | 加入氢氧化钠溶液 | B. | 加入铁粉 | ||
| C. | 加入铜粉 | D. | 通入氯气 |
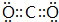 ;用电子式表示化合物 C2D 的形成过程
;用电子式表示化合物 C2D 的形成过程 .
.