题目内容
16.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
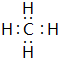 、
、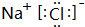
(3)用电子式表示离子化合物E2D、BD2的形成过程:
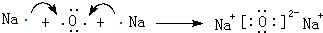 、
、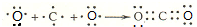
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
分析 由元素在短周期中的位置,可知A为氢、B为碳、C为氮、D为氧、E为Na、F为Al、G为Cl.
(1)由F的位置可知,F处于第三周期ⅢA族;
(2)CH4分子中C原子与H原子之间形成1对共用电子对;NaCl属于离子化合物,由钠离子与氯离子构成;
(3)Na2O由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成;
CO2分子中C原子与氧原子之间形成2对个用电子式,用C原子、O原子电子式表示其形成;
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4,二者发生中和反应生成Al(ClO4)3与H2O.
解答 解:由元素在短周期中的位置,可知A为氢、B为碳、C为氮、D为氧、E为Na、F为Al、G为Cl.
(1)由F的位置可知,F处于第三周期ⅢA族,故答案为:三、ⅢA;
(2)CH4分子中C原子与H原子之间形成1对共用电子对,其电子式为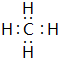 ,NaCl属于离子化合物,由钠离子与氯离子构成,电子式为
,NaCl属于离子化合物,由钠离子与氯离子构成,电子式为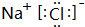 ,
,
故答案为: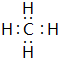 ;
;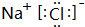 ;
;
(3)Na2O由钠离子与氧离子构成,用Na原子、O原子电子式表示其形成为: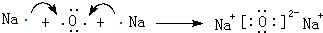 ,
,
CO2分子中C原子与氧原子之间形成2对个用电子式,用C原子、O原子电子式表示其形成为: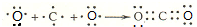 ,
,
故答案为: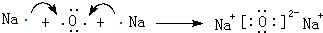 、
、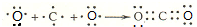 ;
;
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4,二者发生中和反应生成Al(ClO4)3与H2O,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3;HClO4; Al(OH)3+3H+=Al3++3H2O.
点评 本题考查元素周期表、常用化学应用,侧重对电子式的考查,难度不大,需要学生熟练掌握元素周期表的结构,注意理解掌握用电子式表示物质或化学键的形成.

练习册系列答案
相关题目
6.元素X的原子获得3个电子或Y的原子失去了2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下反应产物的化学式为( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y3 | D. | Y2X3 |
7.电子数相等的粒子叫做等电子体,下列各组粒子属于等电子体是( )
| A. | NO和NO2 | B. | CO和CO2 | C. | CO2和SO2 | D. | CH4和NH3 |
20.下列有机物分子中有三种不同的氢原子,且氢原子个数之比为3:2:1的是( )
| A. | CH3CHO | B. | CH3COOC2H5 | C. | CH3COOH | D. | CH3CH2OH |
 .
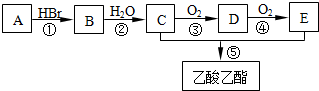
.
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: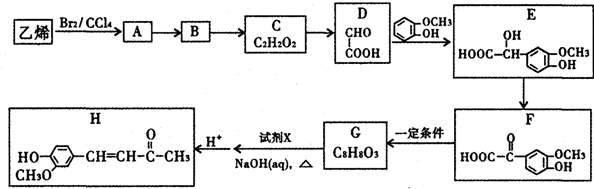
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ 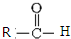 +CO2
+CO2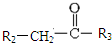 $\stackrel{NaOH(aq),△}{→}$
$\stackrel{NaOH(aq),△}{→}$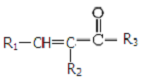 +H2O
+H2O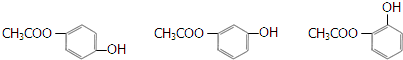 (其中之一).
(其中之一).