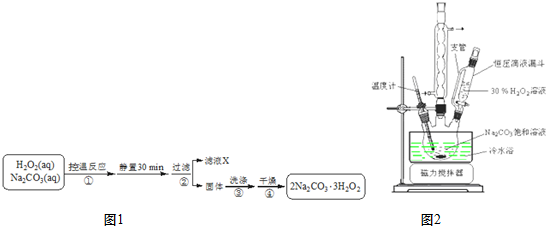
题目内容
1.(1)X的基态原子核外有3个原子轨道充满电子,其价电子排布式为2s22p4(2 )M+中3d能级的轨道在半充满状态其原子的电子排布式为1s22s22p63s23p63d54s1
(3)E元素原子核外有6种不同运动状态的电子,其最高价氧化物的分子的结构式为O=C=O,该分子中σ键与π键个数之比为1:1,写出与该分子互为等电子体的分子的化学式为CS2或N2O.
分析 (1)X的基态原子核外有3个原子轨道充满电子,即1s22s22p4;
(2 )M+中3d能级的轨道在半充满状态,则M+的电子排布式为1s22s22p6 3s2 3p6 3d5;
(3)E元素原子核外有6种不同运动状态的电子,即就有6个电子,为碳元素,最高价为+4价,结合等电子体的定义原子总数相等和价电子总数相等分析解答;
解答 解:(1)X的基态原子核外有3个原子轨道充满电子,即1s22s22p4,所以其价电子排布式为2s22p4,故答案为2s22p4;
(2 )M+中3d能级的轨道在半充满状态,则M+的电子排布式为1s22s22p6 3s2 3p6 3d5,所以其原子的电子排布式为1s22s22p6 3s2 3p6 3d54s1,故答案为:1s22s22p6 3s2 3p6 3d54s1;
(3)E元素原子核外有6种不同运动状态的电子,即就有6个电子,为碳元素,最高价为+4价,所以最高价氧化物的分子的结构式为O=C=O,该分子中σ键为2个,π键为2个,个数之比为1:1,又等电子体为原子总数相等和价电子总数相等,所以与CO2互为等电子体的分子的化学式为CS2或N2O;故答案为:O=C=O,1:1,CS2或N2O;
点评 本题主要考查了元素的推断、核外电子排布以及结构等知识,难度不大,元素推断是解题的关键,答题时注意元素化合物知识的灵活运用.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
12.下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
元素周期表
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
元素周期表
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
16.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)F元素在周期表中的位置是第三周期第ⅢA族.
(2)分别写出BA4、EG的电子式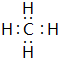 、
、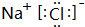
(3)用电子式表示离子化合物E2D、BD2的形成过程: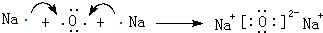 、
、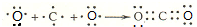
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
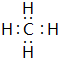 、
、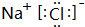
(3)用电子式表示离子化合物E2D、BD2的形成过程:
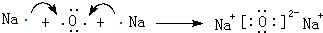 、
、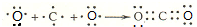
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
6.对于气体交换,下列哪种说法是错误的( )
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |
13.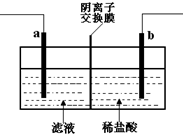 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
5.以下物质;①甲烷;②苯;③聚乙烯;④聚乙炔;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧苯乙烯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
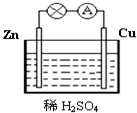 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:
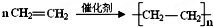 .
.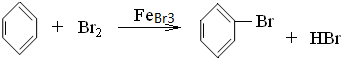 .
.