题目内容
17.下列分子中,所有原子都满足最外层8电子稳定结构的是( )| A. | CCl4 | B. | BeCl2 | C. | BF3 | D. | HClO |
分析 在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足,以此来解答.
解答 解:A.CCl4中,C元素位于第IVA族,则4+4=8,满足分子中所有原子都满足最外层8电子结构,故A选;
B.BeCl2中,Be元素位于第IIA族,则2+2≠8,不满足分子中所有原子都满足最外层8电子结构,故B不选;
C.BF3中,B元素位于第ⅢA族,则3+3≠8,则不满足分子中所有原子都满足最外层8电子结构,故C不选;
D.HClO中,H元素一定不满足8电子结构,故D不选;
故选A.
点评 本题考查原子核外电子数,明确元素的位置、最外层电子数、成键数即可判断,注意规律的应用来解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列关于铷(Rb)的叙述正确的是( )
| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
8.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )
| A. | 元素W:位于元素周期表中的第三周期,ⅢA族 | |
| B. | 元素X:它的原子中M层比L层少2个电子 | |
| C. | 元素Y:它的焰色反应颜色呈黄色 | |
| D. | 元素Z:它的二价阳离子核外电子总数与氩原子相同 |
5.下列反应中,属于取代反应的是( )
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$\stackrel{乙醇}{→}$CH2=CH2↑+NaBr+H2O |
2.在恒温恒容的容器中进行反应H2?2H,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为( )
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
9.下列关于工业生产的说法正确的是( )
| A. | 在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 | |
| B. | 在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 | |
| C. | 在氯碱工业,电解槽一般用铁网作电极 | |
| D. | 合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法 |
6.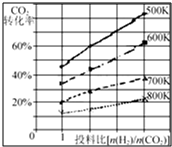 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
则达到平衡时CO的转化率为45%.
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H=2△H1+△H2-2△H3.(用△H1、△H2和△H3表示)
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如右图所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
②升高温度,CO2的转化率降低;
③温度越低,增大投料比使CO2的转化率增大的越显著.
(4)为提高CO2的转化率,除了适当改变温度、压强和投料比外,还可以采取的措施是:将水蒸汽液化移去(或移去产物).
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4.与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是浓H2SO4腐蚀设备或有硫酸废液产生.
1.对于反应2X(g)+Y(g)?2Z(g),下列说法正确的是( )
| A. | 由于K=c2(Z)/[c2(X)•c(Y)],随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 可逆反应达到平衡时,逆反应便立即停止了 | |
| D. | 温度发生变化,上述的K值也发生变化 |

 .
.