11.在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.4 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
10.有关图示装置的叙述不正确的是( )
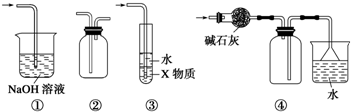

| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
9.近段时间,朝鲜的“核危机”引起了全球的瞩目,其焦点问题就是朝鲜核电站采用轻水堆还是重水堆,重水堆核电站在发电的同时还可以生产出可供研制核武器的钚(${\;}_{94}^{239}$Pu),下列有关${\;}_{94}^{239}$PuPu的说法不正确的是( )
| A. | ${\;}_{94}^{239}$Pu含94个质子 | |
| B. | ${\;}_{94}^{239}$Pu中的中子数和质子数之差为51 | |
| C. | ${\;}_{94}^{239}$Pu中含有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu具有放射性 |
8.下列说法或计算正确的是( )
| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L 1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在反应中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
5.下列正确的是( )
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
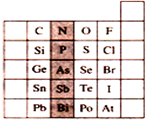
4.右图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
0 168085 168093 168099 168103 168109 168111 168115 168121 168123 168129 168135 168139 168141 168145 168151 168153 168159 168163 168165 168169 168171 168175 168177 168179 168180 168181 168183 168184 168185 168187 168189 168193 168195 168199 168201 168205 168211 168213 168219 168223 168225 168229 168235 168241 168243 168249 168253 168255 168261 168265 168271 168279 203614

| A. | PH3的沸点比NH3高 | |
| B. | PH3的稳定性比H2S强 | |
| C. | 该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 | |
| D. | H3AsO4的酸性比H3PO4弱 |
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知: .
.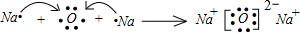 .
. ,该化合物中含有离子键、共价键键(填键的类型).
,该化合物中含有离子键、共价键键(填键的类型).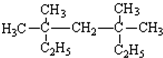 系统命名为:3,3,5,5-四甲基庚烷.
系统命名为:3,3,5,5-四甲基庚烷.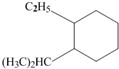 的炔烃的结构简式:
的炔烃的结构简式: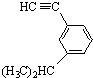 .
.