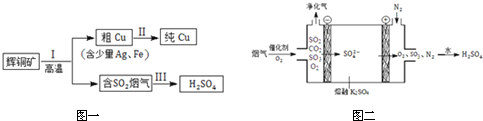
题目内容
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,1L 1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在反应中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
分析 A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.2mol氮原子;
B、羟基不显电性;
C、根据反应前碘元素的化合价可能为+7价、+5价、+3价、+1价或-1价来分析;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.1mol,0.1mol硝酸铵中含有0.2mol氮原子,含有的氮原子数为0.2NA,故A正确;
B、羟基不显电性,故1mol羟基含9mol电子,即9NA个,故B错误;
C、根据反应前碘元素的化合价可能为+7价、+5价、+3价、+1价或-1价,故当生成3mol碘单质的时候转移的电子的物质的量不一定是6mol,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L乙烯的物质的量小于1mol,故含有的C-H的物质的量小于4mol,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
17.下列各组离子能大量共存的是( )?
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
16.下列说法正确的是( )
| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
17.已知氯化铵的电子式 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )
 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )| A. | 属于离子化合物 | B. | 属于共价化合物 | C. | 只含有离子键 | D. | 只含有共价键 |
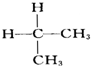 与
与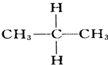
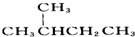 与
与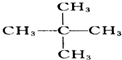
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知: