题目内容
8.下列说法或计算正确的是( )| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |
分析 A.加热蒸发时,HCl挥发,盐酸的浓度降低;
B.根据m(溶质)=m(溶液)×w(溶质)计算氯化钠溶液中NaCl的质量,混合后溶液的质量为氯化钠溶液与水的质量之和,再根据w=$\frac{溶质质量}{溶液质量}$×100%计算混合后溶液质量分数;
C.2.3g钠的物质的量为0.1mol,反应生成4g氢氧化钠,由于反应生成氢气,则溶液质量小于100g;
D.某温度KNO3的溶解度是31.6g,在该温度下将20gKNO3溶解于50g水中,只能溶解15.8g硝酸钾,根据质量分数定义计算判断.
解答 解:A.加热蒸发时,HCl挥发,盐酸的浓度降低,故A错误;
B.100 g 20%的NaCl溶液中NaCl的质量为100g×20%=20g,跟100 g H2O混合后溶液总质量为200g,则混合后NaCl溶液的质量分数是$\frac{20g}{200g}$×100%=10%,故B正确;
C.2.3gNa的物质的量为0.1mol,反应生成4g氢氧化钠,由于反应生成氢气,溶液的质量小于100g,所得溶液的质量分数大于4%,故C错误;
D.故某温度KNO3的溶解度是31.6g,在该温度下将50g水中,溶解硝酸钾质量为31.6g×$\frac{50g}{100g}$=15.8g,则溶液质量分数为$\frac{15.8g}{15.8g+50g}$×100%=24%,故D错误,
故选B.
点评 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数、溶解度等,难度不大,注意A选项中盐酸具有挥发性,C中以计算具体的质量分数数值.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
18.下列反应属于放热反应的是( )
| A. | 锌粒与稀H2SO4反应 | B. | NaOH溶于水 | ||
| C. | CaCO3受热分解 | D. | 氯化铵晶体与氢氧化钡晶体反应 |
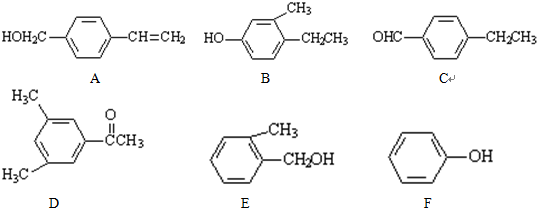
19.下列涉及有机物的性质的说法正确的是( )
| A. | 苯不能使KMnO4溶液褪色,甲苯使KMnO4溶液褪色,因为甲基活化了苯环 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝变成黑色 | |
| C. | 裂化汽油能萃取溴水中的溴,使溴水褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
20.下列实验能够成功的是( )
| A. | 只用溴水一种试剂可鉴别甲苯、己烯、乙醇、四氯化碳四种液体 | |
| B. | 用苯和溴水在Fe催化下可制的溴苯 | |
| C. | 用乙醇、冰醋酸和pH=1的H2SO4溶液混合加热可制备乙酸乙酯 | |
| D. | 检验溴乙烷中的溴元素:向某溴乙烷中加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
17.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ.mo1-1 | |
| B. | 反应①的反应热为221 kJ.mo1-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成l mo1水时放出57.3 kJ的热量 |
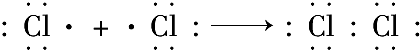 含有非极性键
含有非极性键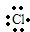 →
→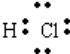 含有极性键键
含有极性键键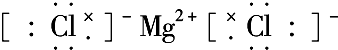 含有离子键
含有离子键 含有极性键、非极性键
含有极性键、非极性键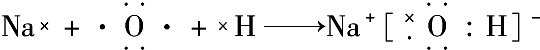 含有离子键、极性键.
含有离子键、极性键.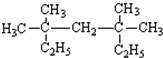 系统命名为:3,3,5,5-四甲基庚烷.
系统命名为:3,3,5,5-四甲基庚烷.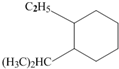 的炔烃的结构简式:
的炔烃的结构简式: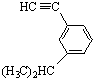 .
.