题目内容
4.右图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )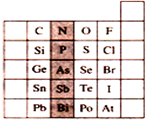
| A. | PH3的沸点比NH3高 | |
| B. | PH3的稳定性比H2S强 | |
| C. | 该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 | |
| D. | H3AsO4的酸性比H3PO4弱 |
分析 A.氨气分子之间存在氢键,沸点高于PH3的;
B.元素非金属性越强,氢化物越稳定;
C.氮元素最高价氧化物对应的水化物化学式均为HNO3;
D.非金属性越强,最高价含氧酸的酸性越强.
解答 解:A.氨气分子之间存在氢键,PH3分子之间存在范德华力,氢键比范德华力更强,故氨气的沸点高于PH3的,故A错误;
B.同主周期自左而右元素非金属性增强,元素非金属性越强,氢化物越稳定,故PH3的稳定性比H2S弱,故B错误;
C.氮元素最高价氧化物对应的水化物化学式均为HNO3,故C错误;
D.同主族自上而下元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故H3AsO4的酸性比H3PO4弱,故D正确,
故选D.
点评 本题考查元素周期律的应用,难度不大,注意理解A选项中氢键对物质性质的影响.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
14.下列装置能达到实验目的是( )
| A. | 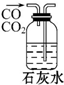 除去杂质气体CO2 | B. | 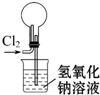 收集并吸收多余Cl2 | ||
| C. | 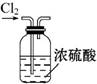 干燥Cl2 | D. |  吸收HCl制盐酸 |
15.有机物A分子式为C6H12O2,它能进行如图转化,则下列说法正确的是( )
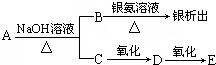

| A. | A可能易溶于水 | B. | B中既有醛基又有羧基 | ||
| C. | C的结构可能是CH3(CH3)2CH2OH | D. | E一定是链状饱和一元酸 |
19.短周期元素W、X、Y的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质.根据以上叙述,下列说法中一定正确的是( )
| A. | 上述三种元素的原子半径大小为Y<X<W | |
| B. | W、X、Y原子的核外最外层电子数的总和为10 | |
| C. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y只能形成含极性共价键的化合物 |
9.近段时间,朝鲜的“核危机”引起了全球的瞩目,其焦点问题就是朝鲜核电站采用轻水堆还是重水堆,重水堆核电站在发电的同时还可以生产出可供研制核武器的钚(${\;}_{94}^{239}$Pu),下列有关${\;}_{94}^{239}$PuPu的说法不正确的是( )
| A. | ${\;}_{94}^{239}$Pu含94个质子 | |
| B. | ${\;}_{94}^{239}$Pu中的中子数和质子数之差为51 | |
| C. | ${\;}_{94}^{239}$Pu中含有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu具有放射性 |
16.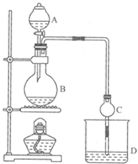 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示
18O位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是防止倒吸、冷凝反应前向D中加入几滴酚酞,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)反应的理想温度范围在77.1-78.5℃,原因是使乙酸乙酯分离出来,防止混入杂质.因此,该装置需要改进的地方是水浴加热.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示
18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O(2)球形干燥管C的作用是防止倒吸、冷凝反应前向D中加入几滴酚酞,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)反应的理想温度范围在77.1-78.5℃,原因是使乙酸乙酯分离出来,防止混入杂质.因此,该装置需要改进的地方是水浴加热.
13.下列有关离子键的叙述中正确的是( )
| A. | 离子化合物中只含有离子键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 含离子键的化合物不一定为离子化合物 | |
| D. | 共价化合物中不含离子键 |
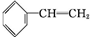 +Br2
+Br2
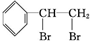 ,反应类型是加成反应;
,反应类型是加成反应; ;
; .
.