题目内容
10.有关图示装置的叙述不正确的是( )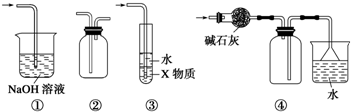
| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
分析 A.导管在液面下,易发生倒吸;
B.长导管进气可收集密度比空气大的气体,短导管进气可收集密度比空气小的气体;
C.X为苯,苯的密度比水的密度小,苯在上层,不能隔绝气体与水;
D.氨气的密度比空气小,利用向下空气法收集,且氨气易溶于水.
解答 解:A.导管在液面下,易发生倒吸,应将导管在液面上,或利用倒扣的漏斗防止倒吸,故A错误;
B.长导管进气可收集Cl2、NO2等,短导管进气可收集H2、NH3,故B正确;
C.X为苯,苯的密度比水的密度小,苯在上层,不能隔绝气体与水,不能防止倒吸,X应为四氯化碳等,故C错误;
D.图中碱石灰干燥氨气,向下空气法收集及尾气处理均合理,故D正确;
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验装置的分析、防倒吸装置、气体的干燥和收集等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.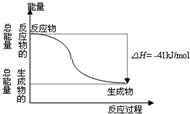 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
1.下列说法正确的是( )
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
5.下列正确的是( )
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
2.下列说法正确的是( )
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
 .
.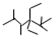 的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,
的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,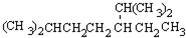 的名称为2,6-二甲基-3-乙基庚烷.
的名称为2,6-二甲基-3-乙基庚烷. ,
,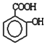 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式: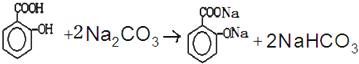 ,
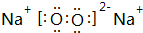
, ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.