15.下列各组物质的性质,从左到右依次递减的是( )
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
14.下列说法中,不正确的是( )
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
13.下列解释实验事实的反应方程式不正确的是( )
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
11.据报道,放射性的${\;}_{53}^{125}$I对治疗肿瘤有一定疗效.该原子的原子核内的中子数是( )
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
9.直接排放含SO2的烟气会形成酸雨,危害环境.可利用氢氧化钠溶液脱除烟气中的SO2.
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由上表判断,NaHSO3溶液显酸性性,用化学用语结合简单文字解释:HSO3-=H++SO32-、HSO3-+H2O=H2SO3+OH-,因为HSO3-电离大于水解,所以显酸性
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
7.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,甲容器保持体积不变,乙容器保持压强不变,在相同温度下,发生2SO2(g)+O2(g)?2SO3(g)并达到平衡.则下列说法不正确的是( )
| A. | 平均反应速度:乙>甲 | B. | 平衡时SO3的物质的量甲>乙 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时混合气体的密度甲<乙 |
6.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
0 168068 168076 168082 168086 168092 168094 168098 168104 168106 168112 168118 168122 168124 168128 168134 168136 168142 168146 168148 168152 168154 168158 168160 168162 168163 168164 168166 168167 168168 168170 168172 168176 168178 168182 168184 168188 168194 168196 168202 168206 168208 168212 168218 168224 168226 168232 168236 168238 168244 168248 168254 168262 203614
| A. | 再通入少量氯气,$\frac{C({H}^{+})}{C(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,溶液呈中性时,c(Na+)=c(Cl-)+c(ClO-) | |
| D. | 加入少量水,水的电离平衡向正反应方向移动 |
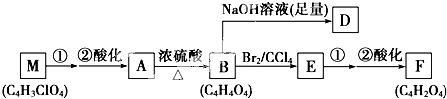
 +(2n-1)H2O.
+(2n-1)H2O. .
.