题目内容
15.下列各组物质的性质,从左到右依次递减的是( )| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 还原性:HCl、HBr、HI | ||
| C. | 酸性:HClO4、H2SO4、H3PO4 | D. | 稳定性:HI、HBr、HCl |
分析 A.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
B.元素的非金属性越强,对应的氢化物的还原性越弱;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.金属性:Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2>Al(OH)3,故A错误;
B.非金属性:Cl>Br>I,元素的非金属性越强,对应的氢化物的还原性越弱,则还原性:HI>HBr>HCl,故B错误;
C.同周期元素从左到右元素的非金属性之间增强,则非金属性:Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>H2SO4>H3PO4,故C正确;
D.非金属性:Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HI<HBr<HCl,故D错误.
故选C.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度中等,本题注意把握元素周期律的递变规律,把握元素的性质与元素对应单质、化合物的性质的之间的关系.

练习册系列答案
相关题目
6.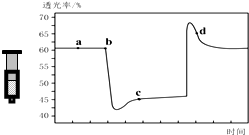 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
3.25℃时,下列各溶液中关系的叙述中,正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
20.铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+.
(3)若将(2)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应Cu=2Cu2++2e-(或Cu-2e-=Cu2+).
(4)下表中,对陈述I、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
7.常温下,下列有关溶液的说法不正确的是( )
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
12.分子式为C5H12O的有机物可以与Na反应放出H2,则其同分异构体中,含有三个甲基的有机物共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
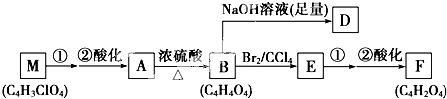
 +(2n-1)H2O.
+(2n-1)H2O. .
.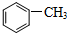 )中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(
)中碳原子的杂化方式有SP2、SP3,甲苯能被酸性KMnO4溶液氧化成苯甲酸(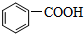 ),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.
),苯甲酸的沸点明显高于甲苯,其主要原因是苯甲酸分子间存在氢键.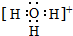 ,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.
,H3O+的键角大于(填“大于”、“小于”或“等于”)水分子的键角.