题目内容
6.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )| A. | 再通入少量氯气,$\frac{C({H}^{+})}{C(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,溶液呈中性时,c(Na+)=c(Cl-)+c(ClO-) | |
| D. | 加入少量水,水的电离平衡向正反应方向移动 |
分析 A、氯气与水的反应,加入氯气,溶液为饱和溶液;
B、通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,平衡左移,漂白性减弱;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-),加入少量固体NaOH,溶液为中性时c(Na+)=c(Cl-)+c(ClO-);
D、氯气与水的反应,加入水,溶液酸性减弱,促进水的电离.
解答 解:在氯水中存在如下平衡:Cl2+H2O?HCl+HClO、H2O?H++OH-、HClO?H++ClO-.
A.氯气溶于水达到平衡后,再通入少量氯气,此时已经为饱和溶液,浓度比值$\frac{C({H}^{+})}{C(Cl{O}^{-})}$不变,故A错误;
B、通入少量SO2,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,平衡左移,HClO的浓度减小,溶液漂白性减弱,故B错误;
C、加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),溶液呈中性,则有:c(H+)=c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),故C正确;
D、加入少量水,溶液酸性减弱,促进水的电离,水的电离平衡向正反应方向移动,故D正确.
故选CD.
点评 本题既考查了化学平衡,又考查了电离平衡,注意次氯酸是一种弱电解质,在增加HClO时,其电离程度减小,在水中加酸或碱都抑制了水的电离.

练习册系列答案
相关题目
16.某有机物的结构简式如下,关于该有机物的下列叙述不正确的是( )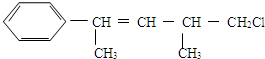
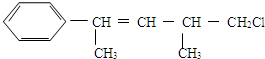
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和4 molH2反应 | |
| D. | 一定条件下,能发生取代反应 |
1.反应2C+O2=2CO 的能量变化如右图所示.下列说法正确的是( )
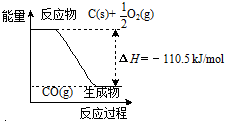

| A. | 12gC(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5kJ | |
| B. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ |
11.据报道,放射性的${\;}_{53}^{125}$I对治疗肿瘤有一定疗效.该原子的原子核内的中子数是( )
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
15.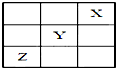 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
3.在光照条件下,CH4与Cl2能发生取代反应.若将1mol CH4与Cl2反应,待反应完成后测得四种有机取代物的物质的量之比为n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=1:2:3:4,则消耗的Cl2为( )
| A. | 1.0 mol | B. | 2.0 mol | C. | 3.0 mol | D. | 4.0 mol |

 ,E、H中所含官能团的名称分别是羟基、碳碳双键.
,E、H中所含官能团的名称分别是羟基、碳碳双键. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O、n
+H2O、n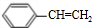 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).