题目内容
7.体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,甲容器保持体积不变,乙容器保持压强不变,在相同温度下,发生2SO2(g)+O2(g)?2SO3(g)并达到平衡.则下列说法不正确的是( )| A. | 平均反应速度:乙>甲 | B. | 平衡时SO3的物质的量甲>乙 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时混合气体的密度甲<乙 |
分析 2SO2(g)+O2(g)?2SO3(g)正反应是气体体积减小的反应,而甲容器保持体积不变,乙容器保持压强不变,但体积减小,乙相当在甲的基础上加压,所以过程中乙容器中压强大于甲容器,反应速率大于甲,达到平衡的时间短,由此分析解答.
解答 解:2SO2(g)+O2(g)?2SO3(g)正反应是气体体积减小的反应,而甲容器保持体积不变,乙容器保持压强不变,但体积减小,乙相当在甲的基础上加压,所以过程中乙容器中压强大于甲容器,反应速率大于甲,
A、所以平均反应速度:乙>甲,故A正确;
B、乙相当在甲的基础上加压,平衡向生成三氧化硫的方向移动,所以平衡时SO3的物质的量甲<乙,故B错误;
C、乙相当在甲的基础上加压,平衡正向移动,所以平衡时SO2的转化率:乙>甲,故C正确;
D、乙的体积减小,而气体的质量不变,所以密度甲<乙,故D正确;
故选B.
点评 本题考查了化学平衡的影响因素分析判断,恒温恒容、恒温恒压容器的变化特征,题目难度中等,掌握分析方法是关键.

练习册系列答案
相关题目
17.下列各组中的反应,属于同一反应类型的是( )
| A. | 由2-溴丙烷制2-丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯制对硝基甲苯;由甲苯制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯与溴水反应制1,2-二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯与水反应制苯甲酸和乙醇 |
15.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性.X为n个C60连接而成的物质,结构如图:
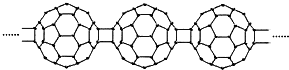
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | C60转变为X是物理变化 | B. | X中含有极性共价键 | ||
| C. | X与金刚石互为同素异形体 | D. | X能够发生加成反应 |
2.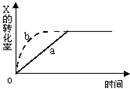 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
16.下列有关σ键、π键的说法错误的是( )
| A. | 一般碳碳σ键比π键重叠程度大,形成的共价键强 | |
| B. | 分子中含有共价键,则至少含有一个σ键 | |
| C. | 在气体单质中,一定有σ键,可能有π键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键 |
4.下列关于有机化合物的说法正确的是( )
| A. | 煤的液化过程为物理过程 | |
| B. | 甲烷和乙烯都可以与氯气反应 | |
| C. | 酸性高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
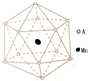 准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构.
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构. ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl; ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).