题目内容
13.下列解释实验事实的反应方程式不正确的是( )| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
分析 A.二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水;
B.钠与氧气在常温下反应生成氧化钠;
C.二氧化硫具有还原性,能够与氧气、碳酸钙反应生成硫酸钙和二氧化碳;
D.不符合客观事实,酸性溶液中氢氧根离子不能大量存在.
解答 解:A.二氧化硅与氢氧化钠反应方程式:SiO2+2NaOH=Na2SiO3+H2O,故A正确;
B.钠与氧气在常温下反应生成氧化钠,化学方程式:4 Na+O2=2Na2O,故B正确;
C.二氧化硫具有还原性,能够与氧气、碳酸钙反应生成硫酸钙和二氧化碳,反应化学方程式:O2+2CaCO3+2SO2=2CO2+2CaSO4,故C正确;
D.酸性KI淀粉溶液久置后变蓝,离子方程式:4I-+O2+4H+=2I2+2H2O,故D错误;
故选:D.
点评 本题考查了化学方程式、离子方程式书写正误的判断,明确反应实质是解题关键,注意钠与氧气反应条件不同对应产物不同,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
3.X、Y、Z、W均为短周期元素,X是地壳中含量最高的元素,Z2+与X2-具有相同的电子层结构,W原子的最外层电子数是其内层电子数的2倍,Y与W同主族.下列说法正确的是( )
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
4.现有室温下四种溶液,有关叙述不正确的是( )
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va :Vb=11:9 |
1.反应2C+O2=2CO 的能量变化如右图所示.下列说法正确的是( )
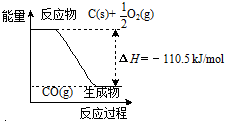

| A. | 12gC(s)与一定量O2(g)反应生成14g CO(g),放出的热量为110.5kJ | |
| B. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ |
5.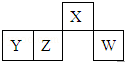 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
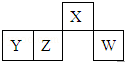 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | X的氢化物与氯化氢反应的产物溶于水形成的溶液呈酸性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 含Y元素的盐溶液一定显酸性 |
2.向AgNO3溶液中加入过量氨水,可生成[Ag(NH3)2]OH.下列说法正确的是( )
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
10.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应:N2+3H2?2NH3.下列有关说法不正确的是( )
| A. | 若2分钟达到化学平衡时N2还剩下0.4mol,则v(N2)=0.3mol/(L•min) | |
| B. | 达到化学平衡时,单位时间内每生成0.1mol的H2同时生成0.1mol的NH3 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡后,若增大压强使容器体积缩小,化学反应速率将会增大 |