题目内容
14.下列说法中,不正确的是( )| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 吸热反应一定需要加热的条件 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 反应物和生成物总能量的相对大小决定化学反应放出还是吸收能量 |
分析 化学反应中的能量变化,通常表现为热量的变化.如果反应物所具有的总能量高于生成的总能量,则在反应中会有一部分能量转变为热能的形式释放,这就是放热反应,反之则是吸热反应,并注意反应条件与反应吸热、放热无关.
解答 解:A、化学反应中的能量变化通常表现为热量的变化,有时以热能、光能、电能等形式转化,故A正确;
B、反应是吸热还是放热决定于反应物和生成物能量高低,与反应条件无关,例如氢氧化钡晶体与氯化铵反应吸热,反应不需要任何条件,故B错误;
C、化学键断裂需要吸收能量,化学键的形成需要释放能量,所以化学键的断裂和形成是化学反应中能量变化的主要原因,故C正确;
D、反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热,故D正确;
故选B.
点评 本题考查化学反应中的能量变化.化学反应中的能量变化通常表现为热量的变化.

练习册系列答案
相关题目
4.我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述正确的是( )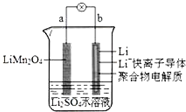

| A. | a为电池的负极 | |
| B. | 放电时,溶液中的Li+从a向b迁移 | |
| C. | 放电时,a极锂元素的化合价发生变化 | |
| D. | 电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
5.下列说法正确的是( )
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
2.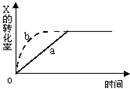 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
9.直接排放含SO2的烟气会形成酸雨,危害环境.可利用氢氧化钠溶液脱除烟气中的SO2.
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由上表判断,NaHSO3溶液显酸性性,用化学用语结合简单文字解释:HSO3-=H++SO32-、HSO3-+H2O=H2SO3+OH-,因为HSO3-电离大于水解,所以显酸性
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
6.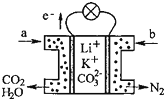 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )| A. | 此电池在常温时也能工作 | |
| B. | 正极电极反应式为:O2+2CO2+4e-=2CO32- | |
| C. | CO32-向正极移动 | |
| D. | a为CH4,b为CO2 |
 ,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl;
,与B的离子具有相同电子数的微粒中,有一种分子可与盐酸化合生成一种盐,该反应的化学方程式是NH3+HCl═NH4Cl; ,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式).
,周期表中与C上下相邻的同主族元素形成的气态氢化物中,稳定性最强的是HF(填氢化物化学式). .
.
 .
.