7.已知金属单质X、Y、Z、W之间有下列关系
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
6.下列不属于化学电源的是( )
| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
5.下列各组的排列顺序中,正确的是( )
| A. | 原子半径 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 稳定性 HF<HCl<HBr | D. | 碱性 NaOH<Mg(OH)2<Al(OH)3 |
4.将一定质量的固体NH4I置于密闭容器中,在某温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g)
5min后达平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则下列说法不正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g)
5min后达平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则下列说法不正确的是( )
| A. | 用NH3表示反应①的速率为1 mol/(L•min) | |
| B. | 体系中颜色不再变化时,可判断反应均已达平衡 | |
| C. | 该温度下反应①的平衡常数为20 mol2/L2 | |
| D. | 加压时反应②的平衡不会移动 |
3.已知金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据.下列选项中正确的是( )
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | x=794.5 | |
| B. | x=1142.5 | |
| C. | 1mol金刚石的能量一定比1mol CO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为 2C(s)+O2(g)=2CO(g)△H=-790 kJ/mol |
2.有机物M的结构简式为: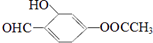 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的分子式为:C9H8O4 | |
| B. | M与乙酸苯乙酯互为同系物 | |
| C. | M可发生水解反应、加成反应、氧化反应 | |
| D. | 1mol M可与3mol NaOH和2mol Br2发生反应 |
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )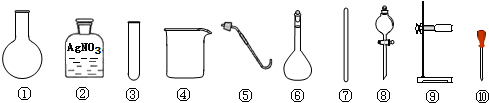

| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
20.下列有关物质的应用与性质相一致的是( )
| A. | SO2可用作漂白剂,原因是具有还原性 | |
| B. | FeCl3溶液可用于制印刷电路板,原因是能氧化Cu | |
| C. | Cl2可制漂白粉,原因是能与NaOH反应 | |
| D. | Al(OH)3可用于治疗胃酸过多,原因是碱性强 |
19.重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
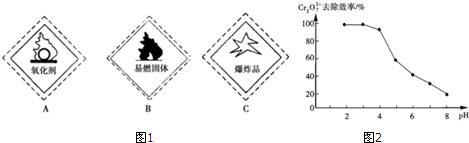
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+ Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
①阴极的电极反应式为2H++2e-=H2↑;Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原.
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)

(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
18.与下列装置相关的说法中不正确的是( )
0 168035 168043 168049 168053 168059 168061 168065 168071 168073 168079 168085 168089 168091 168095 168101 168103 168109 168113 168115 168119 168121 168125 168127 168129 168130 168131 168133 168134 168135 168137 168139 168143 168145 168149 168151 168155 168161 168163 168169 168173 168175 168179 168185 168191 168193 168199 168203 168205 168211 168215 168221 168229 203614
| A. | 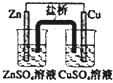 如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. | 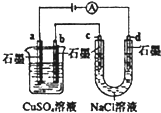 如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. | 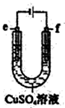 用如图装置精炼铜时,f极为粗铜 | |
| D. | 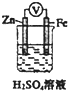 如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |