题目内容
1.下列有关氯化钠的实验中,选用的实验用品都能用到的是( )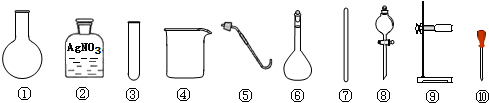
| A. | 除去粗盐中的不溶性杂质,选用 ④⑦⑧⑨ | |
| B. | 检验A的滤液中是否含SO42-,选用 ②③⑩ | |
| C. | 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用 ④⑥⑦⑩ | |
| D. | 用NaCl固体与浓H2SO4共热制备HCl气体,选用 ①⑤⑧⑨ |
分析 A.除去粗盐中的不溶性杂质用过滤;
B.检验SO42-时要避免 SO32- 的影响;
C.用氯化钠固体配制0.1mol/L的氯化钠溶液的步骤有:溶解、转移、洗涤、定容、摇匀等,根据以上配制步骤用到的仪器进行判断;
D.用NaCl固体与浓H2SO4共热制备HCl气体需要加热.
解答 解:A.除去粗盐中的不溶性杂质用过滤,使用漏斗、烧杯、玻璃棒,不能用分液漏斗,故A错误;
B.亚硫酸银是白色沉淀,不能选用硝酸银,应首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,故B错误;
C.用氯化钠配制0.1mol/L的氯化钠溶液,涉及的步骤有:溶解氯化钠,用到烧杯和玻璃棒;转移溶液,用到玻璃棒和容量瓶;洗涤烧杯和玻璃棒;定容溶液,用到胶头滴管,所以使用的仪器有:烧杯、玻璃棒、容量瓶、胶头滴管,故C正确;
D.用NaCl固体与浓H2SO4共热制备HCl气体需要加热,使用酒精灯、圆底烧瓶、分液漏斗、带双孔塞的导管,用不到⑤,故D错误.
故选C.
点评 本题考查常见仪器的使用和化学基本操作的方法,侧重实验装置、仪器的作用的考查,题目难度不大,注意在学习中加强基础知识的积累.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
12.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2
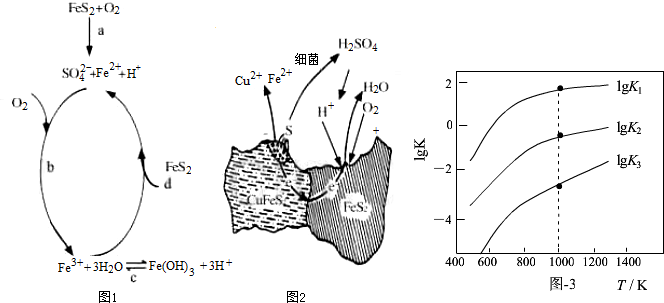
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图2

①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
16.如图,下列装置属于原电池的是( )
| A. | 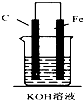 | B. | 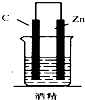 | C. | 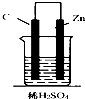 | D. |  |
6.下列不属于化学电源的是( )
| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
13.简单原子的原子结构可用下图形象的表示:
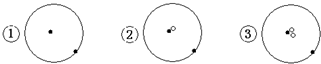
其中 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )

其中
 表示质子或电子,
表示质子或电子, 表示中子,则下列有关的叙述正确的是( )
表示中子,则下列有关的叙述正确的是( )| A. | ①②③是三种化学性质不同的粒子 | B. | ①②③具有相同的质量数 | ||
| C. | ①②③为同素异形体 | D. | ①②③互为同位素 |
10.化学与环境密切相关,下列有关说法正确的是( )
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
11.向H2O2溶液中加入适量稀硫酸酸化的硫酸亚铁溶液,依次观察到如下现象:
①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
①反应刚开始,仅有少量气泡产生;
②反应片刻后,有大量气泡产生;
③试管底部最终出现红褐色沉淀.下列判断正确的是( )
| A. | ①中仅发生一个反应 | |
| B. | Fe3+能催化H2O2的分解 | |
| C. | 反应过程中溶液pH不断减小 | |
| D. | FeSO4与等物质的量的H2O2恰好反应 |
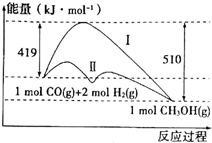 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示. (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)