题目内容
4.将一定质量的固体NH4I置于密闭容器中,在某温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g)
5min后达平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则下列说法不正确的是( )
| A. | 用NH3表示反应①的速率为1 mol/(L•min) | |
| B. | 体系中颜色不再变化时,可判断反应均已达平衡 | |
| C. | 该温度下反应①的平衡常数为20 mol2/L2 | |
| D. | 加压时反应②的平衡不会移动 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,
A.根据v=$\frac{△c}{△t}$计算出用氨气表示的反应速率;
B.达到平衡状态时,正逆反应速率相等,各组分的浓度不再变化,据此进行判断;
C.代入反应①的平衡常数K=c(NH3)•c(HI)计算;
D.加压时,由于反应①中平衡向着逆向移动,导致体系中HI的浓度减小,则反应②的平衡向着逆向移动.
解答 解:平衡时c(HI)=4mol•L-1,HI分解生成的H2的浓度为0.5mol•L-1,
NH4I分解生成的HI的浓度为:4mol•L-1+2×0.5mol•L-1=5mol•L-1,所以NH4I分解生成的NH3的浓度为5mol•L-1,
A.5min后达平衡时,用氨气表示的反应速率为:v=$\frac{5mol/L}{5min}$=1mol/(L•min),故A正确;
B.体系中只有碘单质有色,则体系中颜色不再变化时,说明该反应的正逆反应速率相等,各组分浓度不再变化,可判断反应均已达平衡,故B正确;
C.所以反应①的平衡常数K=c(NH3)•c(HI)=5mol•L-1×4mol•L-1=20mol2•L-2,故C正确;
D.加压后,反应①向着逆向移动,则体系中HI的浓度减小,反应②向着逆向移动,故D错误;
故选D.
点评 本题考查了化学平衡的影响及计算,题目难度中等,根据反应计算出平衡时氨气的浓度为解答关键,注意掌握化学平衡及其影响因素,明确化学平衡常数、化学反应速率的概念及计算方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.一定条件下,将A、B、C三种气体各1mol通入一个密闭容器中发生反应,2A+B?2C,达到化学平衡时,B的物质的量可能是( )
| A. | 1.5mol | B. | 1mol | C. | 0mol | D. | 0.5mol |
15.下列说法不正确的是( )
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蛋白质溶液遇醋酸铅溶液发生盐析 | |
| C. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应 | |
| D. | 乙二醇、甲醛、α-羟基丙酸(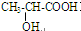 )都可发生缩聚反应 )都可发生缩聚反应 |
12.利用图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 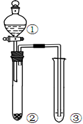 |
| A | 稀硫酸 | Na2CO3 | C6H5ONa | 酸性:H2CO3>C6H5OH | |
| B | 液溴和苯 | 铁屑 | AgNO3溶液 | 液溴和苯发生取代反应 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐可以生成白色沉淀 | |
| D | 浓盐酸 | KMnO4 | FeBr2溶液 | 氧化性:Cl2>Br2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
19.重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
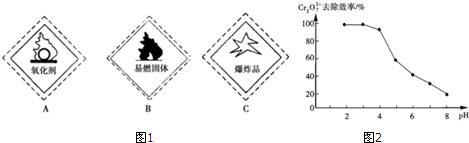
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+ Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
①阴极的电极反应式为2H++2e-=H2↑;Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原.
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)

(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
9.下列物质中,加入水中显著放热并且生成碱的是( )
| A. | 生石灰 | B. | 食盐 | C. | 浓硫酸 | D. | 硝酸铵 |
16.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入番茄中 | |
| D. | 用铜片、铁片作电极插入酒精中 |
13.硒(Se)与硫在元素周期表中位于同一主族.下列说法不正确的是( )
| A. | 原子半径:Se>S | B. | 沸点:H2S>H2Se | ||
| C. | 稳定性:H2S>H2Se | D. | 酸性:H2SO4>H2SeO4 |
14.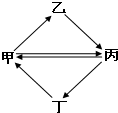 下列各组物质按如图所示转化关系每一步都能一步实现的是
下列各组物质按如图所示转化关系每一步都能一步实现的是
( )
 下列各组物质按如图所示转化关系每一步都能一步实现的是
下列各组物质按如图所示转化关系每一步都能一步实现的是| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | C | CO | CO2 | H2CO3 |
| D | NH3 | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |