题目内容
5.下列各组的排列顺序中,正确的是( )| A. | 原子半径 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 稳定性 HF<HCl<HBr | D. | 碱性 NaOH<Mg(OH)2<Al(OH)3 |
分析 A.同周期从左向右原子半径减小;
B.非金属性越强,最高价氧化物的水化物酸性越强;
C.非金属性越强,气态氢化物越稳定;
D.金属性越强,最高价氧化物的水化物碱性越强.
解答 解:A.同周期从左向右原子半径减小,则原子半径为Na>Mg>Al,故A错误;
B.非金属性为S>C>Si,最高价氧化物的水化物酸性为H2SiO3<H2CO3<H2SO4,故B正确;
C.非金属性为F>Cl>Br,气态氢化物稳定性为HF>HCl>HBr,故C错误;
D.金属性为Na>Mg>Al,最高价氧化物的水化物碱性为NaOH>Mg(OH)2>Al(OH)3,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、元素性质比较为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
13.A,B,C,D四种短周期主族元素的原子序数依次减小,D在短周期主族元素中原子半径最大,C原子最外层电子数与电子层数相等,B元素的主要化合价:最高正价+最低负价=4,下列说法正确的是( )
| A. | C的氧化物是碱性氧化物 | |
| B. | D与A能形成原子个数比为1:1型的离子化合物 | |
| C. | 最高价氧化物对应水化物的酸性:B>A | |
| D. | 工业上电解由A,C两种元素组成的化合物制备C单质 |
16.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(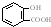 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: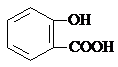 +HCO3-→ +HCO3-→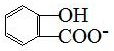 +CO2↑+H2O +CO2↑+H2O |
13.如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是( )
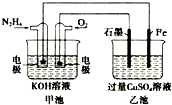

| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
20.下列有关物质的应用与性质相一致的是( )
| A. | SO2可用作漂白剂,原因是具有还原性 | |
| B. | FeCl3溶液可用于制印刷电路板,原因是能氧化Cu | |
| C. | Cl2可制漂白粉,原因是能与NaOH反应 | |
| D. | Al(OH)3可用于治疗胃酸过多,原因是碱性强 |
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请回答:
(1)编号元素中,化学性质最不活泼元素的原子结构示意图是Ne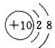 .
.
(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为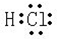 ,
,
(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为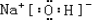 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为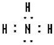 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).
(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
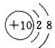 .
.(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为
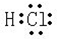 ,
,(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为
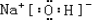 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为
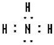 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
17.H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g) 每1molHI生成放出的能量是a kJ.已知:

(a、b、c均大于零)下列说法正确的是( )

(a、b、c均大于零)下列说法正确的是( )
| A. | H2、I2和HI都是共价化合物 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+2a) kJ | |
| C. | 相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入1 mol H2(g)和1 mol I2(g),充分反应后放出的热量为2a kJ |
14.下列关于有机化合物的说法正确的是( )
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 糖类、油脂和蛋白质都能发生水解反应 | |
| C. | 乙醇和乙酸都能与金属钠反应 | |
| D. | 葡萄糖能发生氧化反应和银镜反应 |
15.下列实验装置进行相应的实验,能达到实验目的是( )
| A. | 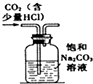 图装置:除去二氧化碳中的少量氯化氢气体 | |
| B. | 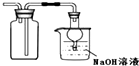 图装置:收集二氧化硫并吸收尾气 | |
| C. |  图装置:用酸性高锰酸钾溶液滴定过氧化氢溶液 | |
| D. |  图装置:用水吸收氯化氢气体并防止倒吸 |