题目内容
3.已知金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据.下列选项中正确的是( )| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | x=794.5 | |
| B. | x=1142.5 | |
| C. | 1mol金刚石的能量一定比1mol CO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为 2C(s)+O2(g)=2CO(g)△H=-790 kJ/mol |
分析 A、B.金刚石燃烧的方程式为C+O2=CO2,根据化学键的断裂和形成的数目进行计算x;
C.因为金刚石的燃烧热为395kJ/mol,则根据能量守恒,则1mol金刚石的能量和1mol氧气的能量之和比1molCO2能量高395kJ判断;
D.根据金刚石的燃烧热为395kJ/mol书写热化学方程式为C(s)+O2(g)=CO2(g)△H=-395kJ/mol.
解答 解:A、B.金刚石燃烧的方程式为C+O2=CO2,因为在金刚石结构中平均1mol碳形成2mol碳碳单键,所以1mol金刚石完全燃烧需拆开2mol C-C、1mol O=O,形成2molC=O,所以2molx-2mol×348kJ/mol-1mol×498kJ/mol=395kJ,解得x=794.5KJ,故A正确,B错误;
C.因为金刚石的燃烧热为395kJ/mol,则根据能量守恒,则1mol金刚石的能量和1mol氧气的能量之和比1molCO2能量高395kJ,但不能确定1mol金刚石的能量一定比1molCO2能量高,故C错误;
D.因为金刚石的燃烧热为395kJ/mol,所以金刚石燃烧的热化学方程式为C(s)+O2(g)=CO2(g)△H=-395kJ/mol,故D错误;
故选:A.
点评 本题考查热化学方程式的书写方法和计算应用,注意焓变和键能之间的关系,特别是注意分析金刚石的结构,正确判断共价键的数目是计算难点,学习中要准确把握.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
14.实验室常用反应NaNO2+NH4Cl=NaCl+N2↑+2H2O制取N2.下列有关说法正确的是( )
| A. | NaNO2是氧化剂 | B. | N2的电子式是 | ||
| C. | 生成1 mol N2时转移6 mol 电子 | D. | 氧化剂和还原剂的质量之比是1:1 |
11.下列反应前后物质的总能量变化可用如图表示的是( )


| A. | H-F═H+F | B. | Mg+2H+=Mg2++H2↑ | ||
| C. | 2Na+2H2O=2Na++2OH-+H2↑ | D. | HNO3+NaOH=NaNO3+H2O |
18.与下列装置相关的说法中不正确的是( )
| A. | 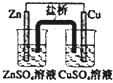 如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. | 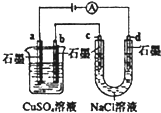 如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. | 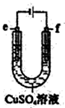 用如图装置精炼铜时,f极为粗铜 | |
| D. | 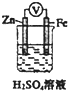 如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
15.下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 丙烯、环丙烷 | B. | 乙酸、甲酸甲酯 | C. | 乙烯、1-丁烯 | D. | 甲醛、甲酸甲酯 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | |
| B. | 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| C. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3˙H2O═AlO2-+4NH4++2H2O | |
| D. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-═Mn2++2Cl2↑+2H2O |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1 L0.1 mol/L NaHCO3溶液中含有的HCO3- 数目为0.1 NA | |
| C. | 1 L PH=1的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 LCO和CO2混合气体中含有的氧原子数为0.15NA |
