10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
6.下列装置或操作能达到实验目的是( )
| A. | 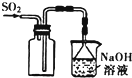 用图所示装置收集SO2气体 | |
| B. | 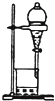 用图所示装置萃取碘水中的碘 | |
| C. | 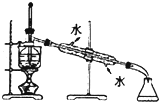 用图所示装置进行石油的分馏 | |
| D. | 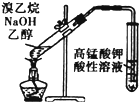 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
5.某强酸性溶液X中含有NH4+、A13+、Ba2+、Fe2+、CO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行如下实验:下列有关推断合理的是( )
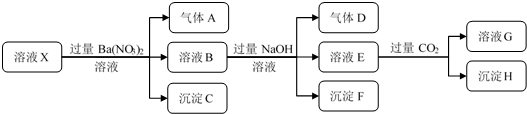

| A. | 溶液中一定没有Ba2+、NO3-、CO32- | |
| B. | 溶液中一定含有H+、NH4+、Fe2+、SO42-、Cl- | |
| C. | 沉淀H为一定Al(OH)3和BaCO3的混合物 | |
| D. | 若溶液X的体积为100 mL,产生标况下112 mL气体A,则X中c(Fe2+)=0.05mol•L-1 |
4.下列说法不正确的是( )
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
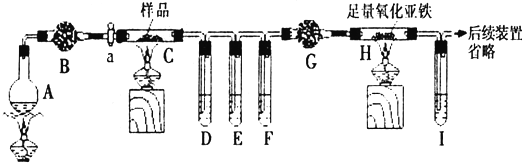
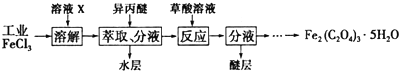
3.某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量.采取的主要操作如图,能达到实验目的是( )


| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
2.常温时,将0.1mol Fe(NO3)3和2mol HCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色.下列有关说法正确的是( )
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
1.根据反应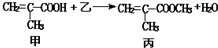 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )
0 167873 167881 167887 167891 167897 167899 167903 167909 167911 167917 167923 167927 167929 167933 167939 167941 167947 167951 167953 167957 167959 167963 167965 167967 167968 167969 167971 167972 167973 167975 167977 167981 167983 167987 167989 167993 167999 168001 168007 168011 168013 168017 168023 168029 168031 168037 168041 168043 168049 168053 168059 168067 203614
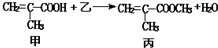 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )| A. | 乙物质为甲醇 | |
| B. | 该反应为取代反应 | |
| C. | 甲与乙都能与金属钠反应产生氢气 | |
| D. | 甲、乙、丙都能与溴的四氯化碳溶液发生加成反应 |
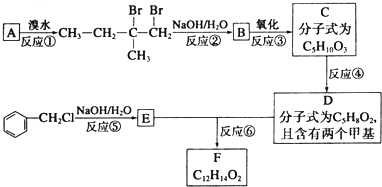
 .
. .
.