题目内容
8.草酸亚铁和草酸铁常用作照相显影剂或制药工业.Ⅰ某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4•2H2O)分解产物的实验探究.他们设计了如下装置进行实验(夹持装置未画出),干燥管B、G中装有无水氯化钙,试管D、F、I中盛有澄清石灰水.
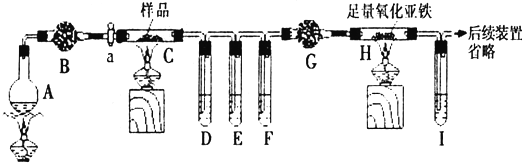
(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,则该反应的化学方程式为NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是用生成的N2排除装置内的空气,避免空气中CO2对实验造成的干扰.
(3)①试管D中出现浑浊,证明分解产物中有CO2存在.
②证明分解产物中存在CO的现象是F中不出现浑浊,I中出现浑浊.
③要证明分解时产生的另一种气态产物的存在,应该如何改进装置在装置C、D之间连一个盛有无水CuSO4的装置.
④将C中充分反心后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为FeO(填化学式).
Ⅱ.三氯化铁是合成草酸铁的重要原料.已知草酸铁晶体在低温时溶解度较小.
(4)利用工业FeCl3(含杂质)制取纯净的草酸铁晶体[Fe2(C2O4)3•5H2O】的实验流程如图所示:
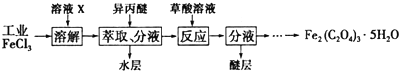
①溶液X为浓盐酸,目的是抑制FeCl3水解.
②上述流程中FeCl3可用异内醚萃取,其原因是FeCl3在异丙醚中的溶解度大于其在水中的溶解度.
③所得Fe2(C2O4)3•5H2O需用冰水洗涤,其目的是除去杂质、减少草酸铁晶体的溶解损耗.
④为测定所得草酸铁晶体的纯度,实验室中用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于酸式(填“酸式”或“碱式”)滴定管中.
分析 (1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,混合加热反应生成氮气、氯化钠和水;
(2)利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,减少误差;
(3)①D中是澄清石灰水,生成沉淀证明生成二氧化碳;
②证明一氧化碳生成可以利用装置F中澄清石灰水不变浑浊,一氧化碳还原氧化铜反应生成二氧化碳通过I澄清石灰水变浑浊;
③结晶水合物分解生成水蒸气,在CD间加一个成无水硫酸铜的干燥管证明水的生成;
④将充分反应后的固体残余物投入经煮沸的稀硫酸中溶解,固体完全溶解且无气体放出,说明无金属铁,取反应液加入KSCN溶液无血红色,证明无铁离子存在,分解生成的固体产物应为氧化亚铁;
(4)①氯化铁水溶液中乙水解变浑浊,溶液X为浓盐酸抑制氯化铁的水解;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中.
解答 解:(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,混合加热反应生成氮气、氯化钠和水,反应的化学方程式为:NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
故答案为:NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,减少测定误差;
故答案为:用生成的N2排除装置内的空气,避免空气中CO2对实验造成的干扰;
(3)①试管D中是澄清石灰水,生成沉淀变浑浊证明生成二氧化碳气体,故答案为:CO2;
②证明分解产物中存在CO的可以利用装置F中澄清石灰水不变浑浊,一氧化碳还原氧化铜反应生成二氧化碳通过I澄清石灰水变浑浊说明,实验现象为:F中不出现浑浊,I中出现浑浊证明生成一氧化碳,
故答案为:F中不出现浑浊,I中出现浑浊,
③结晶水合物分解生成水蒸气,验证水蒸气存在的试剂可以选择无水硫酸铜,在CD间加一个成无水硫酸铜的干燥管,固体变蓝色证明水的生成,
故答案为:在装置C、D之间连一个盛有无水CuSO4的装置;
④故将充分反应后的固体残余物投入经煮沸的稀硫酸中溶解,固体完全溶解且无气体放出,说明无金属铁,取反应液加入KSCN溶液无血红色,证明无铁离子存在,分解生成的固体产物应为氧化亚铁,
故答案为:FeO
(4))①酸化FeCl3用盐酸酸化,不引入杂质,且抑制铁离子的水解,故答案为:抑制氯化铁水解;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度,
故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;
③洗涤是除去沉淀表面杂质,所得Fe2(C2O4)3•5H2O需用冰水洗涤,冰水是减少沉淀溶解损失,故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中,故答案为:酸式.
点评 本题考查了物质性质的、实验基本操作的分析判断,主要是装置作用和实验基本操作,分解产物的实验验证和成分的分析判断,掌握方法和基础是关键,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |

| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: $→_{光照}^{①Cl_{2}}$
$→_{光照}^{①Cl_{2}}$ $→_{△}^{②NaOH/醇}$A$\stackrel{③HBr/H_{2}O_{2}}{→}$B$→_{△}^{④试剂X}$C$\stackrel{⑤氧化反应}{→}$氢化阿托醛
$→_{△}^{②NaOH/醇}$A$\stackrel{③HBr/H_{2}O_{2}}{→}$B$→_{△}^{④试剂X}$C$\stackrel{⑤氧化反应}{→}$氢化阿托醛
 .
. (其中任一种).(写出一种即可).
(其中任一种).(写出一种即可).
 铜是应用较为广泛的有色金属.
铜是应用较为广泛的有色金属.