题目内容
6.下列装置或操作能达到实验目的是( )| A. | 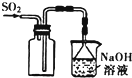 用图所示装置收集SO2气体 | |
| B. | 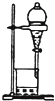 用图所示装置萃取碘水中的碘 | |
| C. | 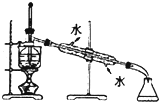 用图所示装置进行石油的分馏 | |
| D. | 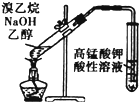 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
分析 A.二氧化硫的密度比空气密度大;
B.萃取碘水中的碘,需要分液漏斗;
C.分馏时测定馏分的温度;
D.乙醇易挥发,乙醇与生成的乙烯均能被高锰酸钾氧化.
解答 解:A.二氧化硫的密度比空气密度大,应利用向上排空气法收集,图中进气导管应长进,故A错误;
B.萃取碘水中的碘,需要分液漏斗,萃取、分液可提纯,则图中分液装置合理,故B正确;
C.分馏时测定馏分的温度,则温度计的水银球应在烧瓶支管口处,故C错误;
D.乙醇易挥发,乙醇与生成的乙烯均能被高锰酸钾氧化,应除去乙醇后再检验溴乙烷与NaOH乙醇溶液共热产生的乙烯,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备及收集、混合物分离提纯、有机物的性质、检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析和实验装置的作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.设nA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
14.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含H2SO4的废水用BaCl2处理后排放 |
1.根据反应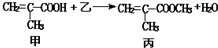 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )
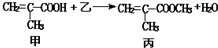 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )| A. | 乙物质为甲醇 | |
| B. | 该反应为取代反应 | |
| C. | 甲与乙都能与金属钠反应产生氢气 | |
| D. | 甲、乙、丙都能与溴的四氯化碳溶液发生加成反应 |
11.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和12.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=10 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
15.三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是
( )
| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
16.乙烷与氯气在光照条件下发生取代反应所得有机物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |