题目内容
7.电化学原理在金属腐蚀、能量转换、物质合成等方面应用广泛.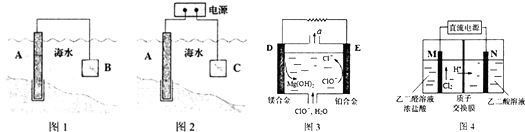
(1)通常可用图l、图2所示的两种方式减缓海水埘钢闸门A的腐蚀,则图l中材料B通常选择c(填字母序号),图2 中材料C最好选择d(填字母序号).
a.钠块 b.铜块 c.锌块 d.石墨
则图2中C上发生的主要电极反应式为2Cl--2e-═Cl2↑.
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.图3为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.
①D为该燃料电池的负极(填“正”或“负”).E电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
②镁燃料电池负极容易发生自腐蚀使负极利用率降低,该过程中产生的气体a为H2(填化学式).
(3)乙醇酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸.
①乙二醛(OHC-CHO)与M电极的气体产物反应生成乙醛酸,则反应的化学方程式为OHC-CHO+Cl2+H2O═HOOC-CHO+2HCl.
②该电解装置工作中若有0.5molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为0.5mol.
分析 (1)形成原电池时,Fe作正极被保护;电解池中Fe作阴极被保护;C为阳极,在海水中阳极上氯离子失电子生成氯气;
(2)①原电池中失电子的为负极;正极上ClO-得电子生成氯离子;
②Mg的活泼性较强能与水反应生成氢气;
(3)①乙二醛(OHC-CHO)与氯气反应生成乙醛酸;
②2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式计算.
解答 解:(1)原电池原理保护金属铁时,将铁与比铁活泼的金属相连;电解池原理保护金属铁时,铁作阴极,阳极接石墨,不需要频繁更换,在海水中阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-═Cl2↑,故答案为:c;d;2Cl--2e-═Cl2↑;
(2)①“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极;正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;
故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
②Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,故答案为:H2;
(3)①乙二醛(OHC-CHO)与M电极的氯气反应生成乙醛酸,化学方程式为:OHC-CHO+Cl2+H2O═HOOC-CHO+2HCl,故答案为:OHC-CHO+Cl2+H2O═HOOC-CHO+2HCl;
②根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,0.5mol H+通过质子交换膜,则生成0.25mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为0.5mol;
故答案为:0.5.
点评 本题考查了原电池原理和电解池原理的分析应用,把握原电池原理和电解池原理以及电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.

| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
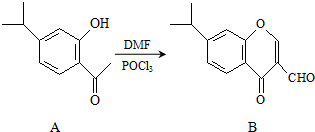 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
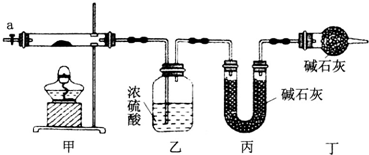
(1)按如图所示装置组装好仪器,并检查装置气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生时(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl2•6H2O的一种工艺如下:

已知;25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 陶瓷刀大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“蔚蓝” |
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |