题目内容
2.常温时,将0.1mol Fe(NO3)3和2mol HCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色.下列有关说法正确的是( )| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
分析 硝酸根离子在酸性条件下具有强氧化性,所以向溶液中加入铁粉后先发生反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,0.1mol硝酸铁中含有0.3mol硝酸根离子,根据反应可知,0.3mol硝酸根离子完全反应消耗1.2mol氢离子,同时生成0.3molNO气体,氢离子还剩余0.8mol;此时溶液中含有Fe3+的物质的量为:0.1mol+0.3mol=0.4mol,然后发生反应:Fe+2Fe3+=3Fe2+,最后发生反应:Fe+2H+=Fe2++H2↑,据此结合题中数据进行计算.
解答 解:硝酸根离子在酸性条件下具有强氧化性,所以向溶液中加入铁粉后先发生反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,0.1mol硝酸铁中含有0.3mol硝酸根离子,根据反应可知,0.3mol硝酸根离子完全反应消耗1.2mol氢离子,同时生成0.3molNO气体,氢离子还剩余0.8mol;此时溶液中含有Fe3+的物质的量为:0.1mol+0.3mol=0.4mol,然后发生反应:Fe+2Fe3+=3Fe2+,最后发生反应:Fe+2H+=Fe2++H2↑,
A.溶液中含有H+、NO3-,其氧化性大于铁离子,所以优先发生反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,故A错误;
B.16.8g铁的物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,根据反应Fe+4H++NO3-=Fe3++NO↑+2H2O可知,0.3mol铁完全反应生成0.3molNO气体,标况下NO的体积为6.72L,故B正确;
C.由于反应后的溶液中滴加KSCN溶液不变红色,则反应后的溶液中不会存在Fe3+,故C错误;
D.反应中至少消耗Fe的物质的量为:n(Fe)=n(NO3-)+$\frac{1}{2}$n总(Fe3+)=0.3mol+0.4mol×$\frac{1}{2}$=0.5mol,质量为:56g/mol×0.5mol=28g;在反应Fe+4H++NO3-=Fe3++NO↑+2H2O、Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+中,溶液的质量一直在增加,故D错误;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的先后顺序为解答关键,注意硝酸根离子在酸性条件下具有强氧化性,为易错点,试题侧重考查学生的分析能力及化学计算能力.

| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
| A. | 最高价氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一种单质是自然界最硬的物质 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
| A. | SO2和Na2SO4 | B. | CO2和H2O | C. | NaOH和NaCl | D. | KCl和HCl |
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| A. | Ba2+对人体无害,可用BaSO4做钡餐造影剂 | |
| B. | 海水提镁和海水提溴都涉及氧化还原反应 | |
| C. | 大量燃烧含硫的化石燃料是形成酸雨的主要原因 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
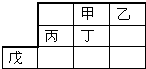
 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 向NaCl0溶液中通人少量二氧化碳的离子方程式为:2C1O-+CO2+H2O=2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | a、b、c三点所示溶液中水的电离程度:c>a>b | |
| D. | 图象中,I表示CH3COOH,Ⅱ表示HC1O,且溶液导电性:c>b>a |
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为2NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | NaBH4是一种重要的储氢载体,1molNaBH4与水反应[NaBH4+2H2O=NaBO2+4H2↑]时转移的电子数目为8NA | |
| D. | 常温下,1L0.2mol/L的盐酸溶液通人氨气当溶液pH=7,则溶液中NH4+数为0.2NA |